研究揭示糖基磷脂酰肌醇转酰胺酶复合物与配体结合的结构和自抑制机制 |
 |
《自然-通讯》(Nature Communications)在线发表了中国科学院分子细胞科学卓越创新中心李典范研究组与复旦大学屈前辉课题组的合作完成的研究成果(Structures of Liganded Glycosylphosphatidylinositol Transamidase Illuminate GPI-AP Biogenesis),揭示了糖基磷脂酰肌醇(GPI)转酰胺酶(GPI-T)复合物识别广泛底物的结构基础和防止意外剪切的自抑制机制。
GPI修饰是真核生物中普遍存在的翻译后修饰。水溶性前体蛋白通过GPI修饰而锚定在细胞膜上,行使包括信号转导、催化、细胞黏附等在内的基本生物学功能。GPI-T是GPI锚定蛋白(GPI-AP)生物合成途径中的关键酶,是一个五元跨膜复合物,负责将前体蛋白C端的信号肽切除并将脂分子GPI连接到新暴露的C末端。与多数蛋白水解酶不同,GPI-T识别的肽段序列不具有序列唯一性,而仅有模糊的亲疏水排列特征。它的切割位点(w位点)通常为侧链较小的氨基酸,且切割位点至C末端疏水段由~10个亲水氨基酸残基的肽段相连(图1a)。如何实现底物宽泛性与催化保真性这一 矛盾统一体 ,是GPI-AP生物合成中重要的生化机制问题。
该研究组前期解析了人源GPI-T的2.53埃冷冻电镜三维结构,揭示了其异源五聚体的组装机制(图1b),但GPI-T同时实现底物宽泛性(图1a)与催化保真性的机制仍不明确。
若回答上述问题,需要解析GPI-T与底物(前体蛋白、GPI)或者与产物(GPI-AP、信号肽)的复合物结构。这是由于GPI分子目前尚不能通过化学方法合成。该团队设计了细胞工程与蛋白质工程方法。研究通过基因敲除与点突变相结合的手段,将GPI-T复合体分别停留在 底物结合 和 产物结合 状态,并解析了二者的高分辨率结构(图2a、b)。结合活性分析体系,该工作揭示了GPI-T同时实现底物宽泛性与催化保真性这一 矛盾统一体 的机制。
研究表明,在保真性上,GPI-T使用一个自抑制环锁定于非活性构象(图2c)。同时,激活过程的构象变化需要打破数个氢键、盐键相互作用并引入电荷及亲疏水排斥。这种多重保护机制避免了因底物宽泛性而造成的意外水解。
研究显示,底物结合GPI-T时,信号肽与复合体的结合提供结合能,促使GPI-T亚基以刚性移动为主的构象变化,启动上述耗能的激活过程,打开自抑制环;同时,信号肽近催化部位的亲水部分通过诱导契合的方式,促使GPI-T催化中心的精确重构(图2d)。
进一步,该团队设计了 功能增强突变体 和 功能丧失突变体 ,证明了所提出的自抑制与底物结合诱导的激活机制。
此外,该工作还揭示了GPI-T识别宽泛性底物的结构基础和催化的生化机制。
研究工作得到国家委员会和中国科学院的支持。

图1. GPI-T的冷冻电镜结构及其活性中心组成。a、GPI-T催化反应及底物特征示意图;b、GPI-T的冷冻电镜密度图。
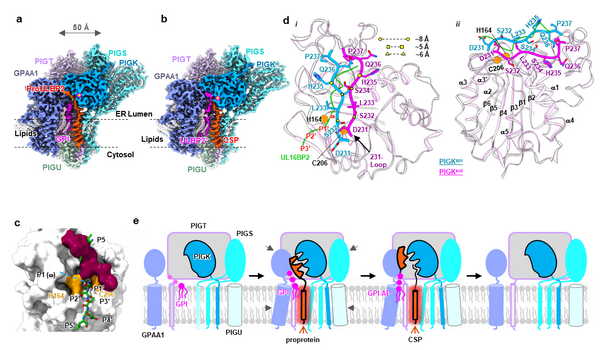
图2. GPI-T与底物、产物结合的结构揭示自抑制与激活机制。a-b:GPI-T与底物(a)、产物(b)的冷冻电镜密度图;c、自抑制环(红色)占据了底物(绿色)结合口袋;d、GPI-T从自抑制状态(蓝色)向活性构象(洋红色)的构象变化;e、GPI-T的激活过程。
医药网新闻
- 相关报道
-
- 别让孩子输在起跑线上?Clin Epigenet 发现:这条起跑线早在爸爸的精子里,表观遗传密码藏着健康答案 (2025-10-27)
- 终结持续25年的争论!娄智勇/饶子和等团队合作最新Cell (2025-10-26)
- 上海药物所×临港实验室合作发表Cell论文:基于结构发现新型抗抑郁小分子 (2025-10-26)
- Mol Cancer:阻断甲状腺激素受体为前列腺癌治疗提供了新的途径 (2025-10-26)
- Science子刊:卞修武团队发现增强CAR-T细胞抗肿瘤效果的基因修饰策略 (2025-10-26)
- Nature Biotechnology:直击囊胚“混沌期”——长时程活体成像首次捕捉人类囊胚的染色体分离灾难 (2025-10-26)
- JNCCN:戒烟也应当是癌症治疗的一环!13万名癌症患者数据分析结果显示,癌症确诊后及时戒烟可大幅降低死亡风险,改善手术预后 (2025-10-26)
- NEJM:人工视网膜,帮助老年性黄斑变性患者恢复视力 (2025-10-25)
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















