Cell子刊:复旦大学骆菲菲/储以微团队开发新型CAR |
 |
来源:生物世界 2025-05-07 16:20
这些研究结果确立了一种基于代谢重编程的新策略,以增强 CAR-T 细胞在恶劣的肿瘤微环境中的适应性,同时保持治疗效果,从而提升 CAR-T 细胞治疗实体瘤的持久性和有效性。复旦大学附属华山医院骆菲菲研究员团队联合复旦大学生物医学研究院/基础医学院储以微教授团队(复旦大学基础医学院牛聪义为论文第一作者)在 Cell 子刊Cell Metabolism上发表了题为:Foxp3 confers long-term efficacy of chimeric antigen receptor-T cells via metabolic reprogramming的研究论文。
该研究首次揭示了Foxp3通过非转录依赖的线粒体动态调控机制,重塑 细胞代谢表型,赋予其突破实体瘤微环境限制的 生存优势 ,基于这一发现构建的CAR-TFoxp3细胞,提高了治疗实体瘤的持久性和有效性。这项研究为实体瘤治疗提供了 增效不增毒 的创新解决方案。

从生理学角度来看,不同 T 细胞亚群的新陈代谢存在差异,并且 T 细胞在分化过程中会转换其代谢途径。初始 T(Tn)淋巴细胞处于静息状态,并依靠氧化磷酸化(OXPHOS)来维持存活。在抗原刺激后,初始 T 细胞分化为效应 T 细胞(Teff),并将其代谢策略从氧化磷酸化转变为有氧糖酵解,这使它们能够执行效应功能。作为 T 细胞的一个亚群,调节性 T 细胞(Treg)的代谢与效应 T 细胞(Teff)不同,其特征为脂质代谢增强,而有氧糖酵解和氧化磷酸化减弱。
Treg 对糖酵解的敏感性较低,葡萄糖转运蛋白 Glut1 的基因缺失对Treg 没有影响,但会抑制 CD4+T 细胞的分化。Treg 中氧化磷酸化水平低归因于 mTORC2 活性的降低,而 -酮戊二酸在 Treg 极化过程中上调氧化磷酸化则会显著减少初始 T 细胞向Treg 的分化。
越来越多的证据表明,Treg 独特的代谢模式使其能够在高增殖的所形成的低氧和酸性肿瘤微环境中长期存活并有效扩增。此外,近期的研究还突出了Foxp3是调节Treg 代谢的关键因子。
然而,Foxp3 是否能够在效应 T 细胞(尤其是 CAR-T 细胞)中过表达从而改变其代谢特性,并使其在肿瘤微环境中实现长期存活和发挥功能,目前尚不清楚。
在这项最新研究中,研究团队通过共表达 Foxp3 和第三代嵌合抗原受体(CAR),构建了 CAR-TFoxp3 细胞,以重新编程 CAR-T 细胞的代谢,并在体外和体内探究了 CAR-TFoxp3细胞的细胞毒性、持久性,并排除了其免疫抑制作用。
具体来说,该研究显示,CAR-TFoxp3细胞表现出明显的代谢重编程,其特征为有氧糖酵解和氧化磷酸化水平下降,同时脂质代谢水平上升。这种代谢转变是由 Foxp3 与动力蛋白相关蛋白-1(Drp1)的相互作用所驱动的。关键的是,CAR-TFoxp3细胞并未获得 Treg 细胞的免疫抑制功能,反而通过 Foxp3 介导的适应性变化,表现出更强的抗肿瘤效力,并且其耗竭标志物的表达降低。
研究团队在人源化免疫系统小鼠模型中证实,CAR-TFoxp3细胞具体强大的抗肿瘤效果,且不具有 Treg 细胞的免疫抑制作用。
该研究的核心发现:
CAR-TFoxp3细胞表现出与常规 CAR-T 细胞截然不同的代谢重编程特征;
Foxp3 与 Drp1 的相互作用促使CAR-TFoxp3细胞发生这种代谢转变;
CAR-TFoxp3细胞不会获得类似 Treg 细胞的免疫抑制功能;
CAR-TFoxp3 细胞表现出更低的耗竭程度和更强的抗肿瘤功效。
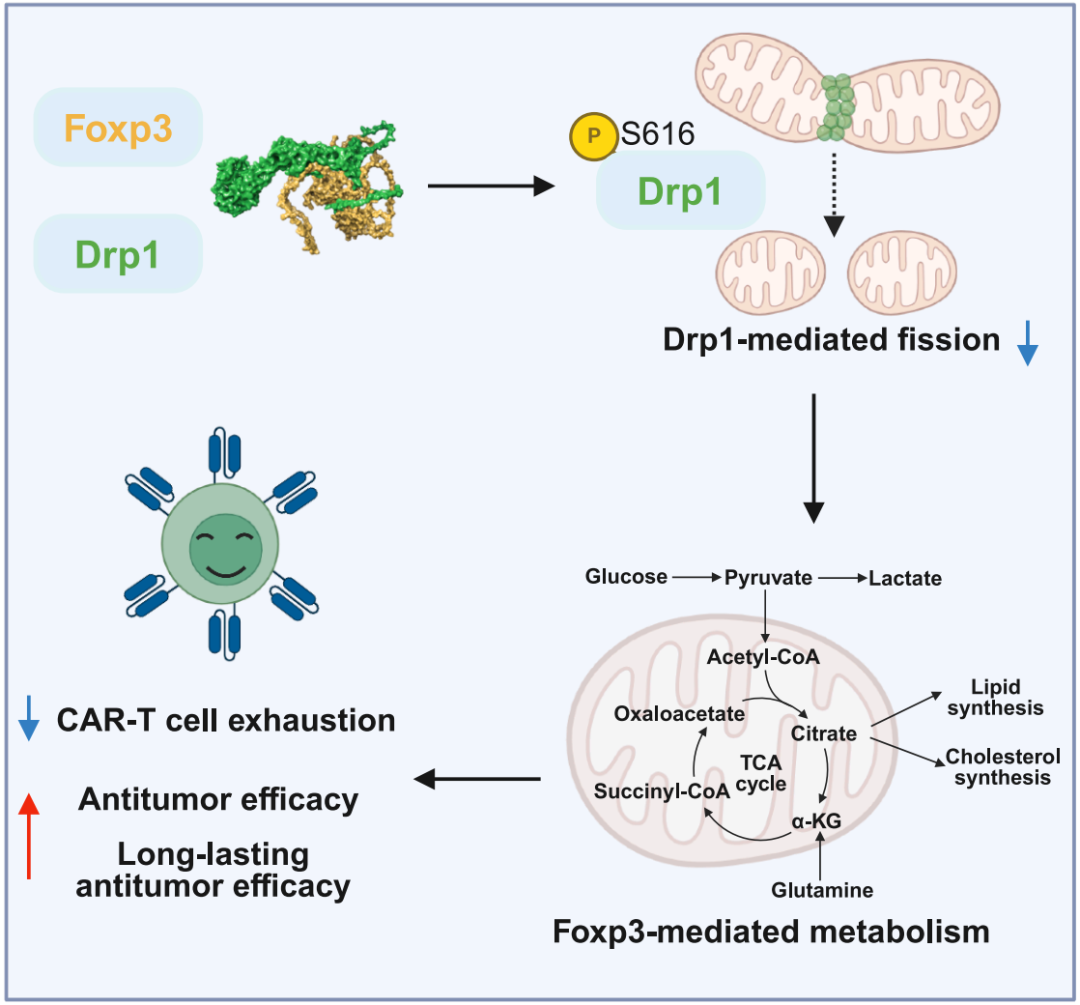
总的来说,这些研究结果确立了一种基于代谢重编程的新策略,以增强 CAR-T 细胞在恶劣的肿瘤微环境中的适应性,同时保持治疗效果,从而提升 CAR-T 细胞治疗实体瘤的持久性和有效性。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制 (2025-09-11)
- 构建中国人衰老时钟,200多位中国学者联合推出X-Age项目(耄耋计划),推动健康长寿研究 (2025-09-11)
- 参天公司青光眼引流器"港澳药械通"上市许可获广东省药监局批准 (2025-09-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















