种子轮融资1亿美元!刘如谦创立新公司,利用新型VLP载体,开发下一代基因药物 |
 |
来源:生物世界 2024-04-11 09:33
2024年4月9日,Nvelop Therapeutics正式宣布,公司计划基于两种经过体内验证的可编程非病毒载体递送平台,开发下一代基因药物。除了在科研领域接连取得重突破以外,基因编辑技术先驱刘如谦(David Liu)还创建了多个基因编辑和治疗领域公司,包括基于CRISPR-Cas9的基因编辑疗法公司EditasMedicine、碱基编辑公司Beam Therapeutis、基因编辑农业公司Pairwise Plants、先导编辑公司Prime Medicine、表观基因编辑公司Chroma Medicine等。
而在2022年,刘如谦还与基因编辑先驱J Keith Young教授联合创立一家新公司 Nvelop Therapeutics,该公司此前一直处于隐身状态,但已完成了来自Newpath Partners、Atlas venture、F-Prime capital和5AM Ventures等著名生命科学风投公司的1亿美元的种子轮融资。
这家新公司正在应对长期困扰基因治疗领域的挑战 如何才能最好地将基因药物安全有效地递送递送给患者?
2024年4月9日,Nvelop Therapeutics正式宣布,公司计划基于两种经过体内验证的可编程非病毒载体递送平台,开发下一代基因药物。

除了两位两位基因编辑先驱刘如谦和J Keith Young联合创始人外,Nvelop 还组建了一支由经验丰富的科学家、行业高管和公司建设者组成的团队,在创新和卓越业务方面享有集体声誉。公司首席执行官Jeff Walsh拥有超过30年的生命科学公司的领导经验,曾担任蓝鸟生物(bluebird bio)的首席财务官和首席战略官。首席科学官Melissa Bonner拥有20年的细胞和基因治疗经验,此前担任蓝鸟生物的研究主管,她领导的团队,为ZyntegloTM、SkysonaTM和LyfgeniaTM这几款基因疗法获得批准上市发挥了重要作用。

从左至右依次为刘如谦、J Keith Young、Jeff Walsh、Melissa Bonner
Nvelop公司首席执行官Jeff Walsh表示,基因医学领域受到有效地将治疗药物递送到体内多种目标细胞的挑战的显著限制。凭借一流的技术、在细胞和基因治疗方面拥有深厚积累的科学创始人,以及率先开发了一些获批基因疗法的团队,Nvelop在解锁基因药物的承诺方面具有独特优势。
该公司的名字 Nvelop 可能来自单词 envelop,envelop有包封之意,代表了该公司的核心技术 新型递送载体。
新型非病毒递送载体 VLP
Nvelop公司同时在开发源自刘如谦实验室和J Keith Young实验室各自开发的两种用于体内递送的可编程非病毒递送载体平台。
2022年1月,刘如谦团队在Cell期刊发表论文【1】,开发了一种无DNA组分的工程化类病毒颗粒(Engineered virus-like particles,eVLP),能够克服体外和体内递送的多个瓶颈。
该研究开发的第四代eVLP,可以有效包装和递送碱基编辑器(base editor)和CRISPR-Cas9的核糖核蛋白(RNP)形式,递送RNP形式,相比直接递送核酸,更具安全性优势。

在eVLP中,通过使用不同的糖蛋白,可以改变它们的细胞和器官靶向性。该研究使用eVLP在人类细胞、小鼠原代细胞和多种小鼠器官和组织(肝脏、大脑、眼睛)中进行有效的基因编辑和治疗。此外,eVLP递送的体外和体内基因编辑,在DNA水平和RNA水平几乎都没有检测到脱靶,相比使用AAV病毒或质粒载体递送优势明显。
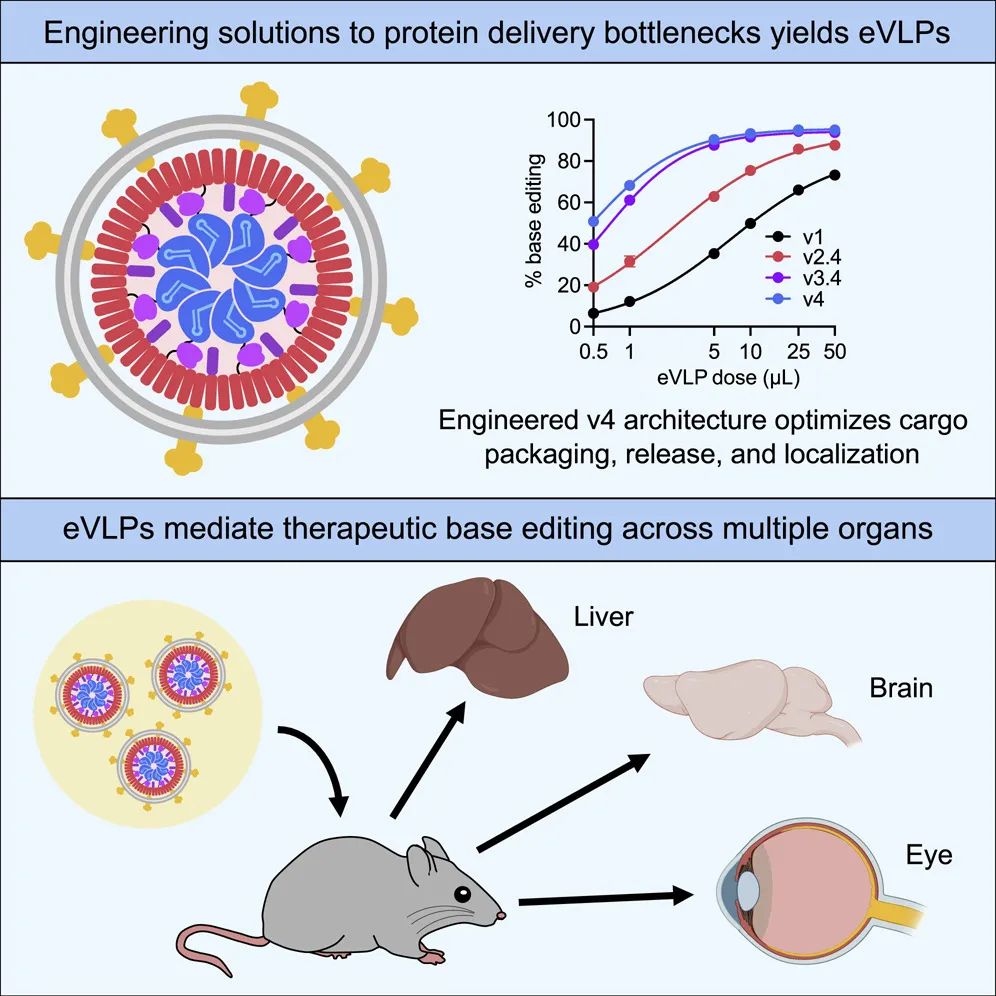
这些研究结果表明,eVLP可作为一种有潜力的治疗性大分子递送载体,它结合了病毒和非病毒递送的关键优势,能够将基因编辑工具递送到细胞和器官,实现高效基因编辑,且具有最低的脱靶效应,安全性很高。
2024年1月,刘如谦团队在NatureBiotechnology期刊发表论文【2】,该研究使用优化的eVLP将先导编辑器(Prime Editor)以RNP形式递送到眼睛,在遗传性失明小鼠模型中实现了体内碱基编辑并恢复了部分视觉功能。

先导编辑器(Prime Editor)相比碱基编辑器(Base Editor)和CRISPR-Cas9,要大上不少,该研究进一步证实了eVLP在递送尺寸更大的基因药物的可行性。此外,优化的eVLP还能减少先导编辑的脱靶编辑、避免基因整合带来的潜在致癌性,增强了先导编辑的安全性。
Nvelop 公司还在开发源自J Keith Young实验室的的VLP平台,他的实验室于2023年7月20日发布的一项专利申请(US2023/0227793)显示了一种增强的VLP,这种VLP包括一个或多个病毒外膜来源的糖蛋白,而不包括来自任何人类的内源性或外源性病毒群特异性抗原(gag)或聚合酶(pol)的蛋白质。此外,他的实验室还有另一项VLP专利申请(US2022/0259617),这是一种人源性VLP,其包括一个或多个人内源性逆转录病毒(HERV)来源的包膜蛋白和gag蛋白。
基因编辑大佬纷纷布局VLP
实际上,不只是刘如谦,基因编辑领域先驱张锋、Jennifer Doudna都非常关注VLP类递送载体,并取得了一些突破。
20223年2月,张锋创立了一家名为Aera Therapeutics的新公司,并完成了总计1.93亿美元的A轮和B轮融资。
该公司基于张锋实验室2021年8月发表的一篇Science论文【3】,该研究发现了一种来自人类的逆转录病毒样蛋白PEG10,它能够与自身的mRNA结合并在其周围形成球型保护囊,张锋团队将其改造设计后用来包装和递送RNA。

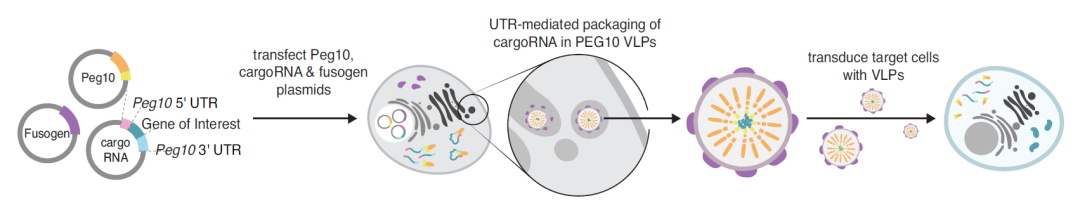
张锋团队将其命名为这种递送载体命名为蛋白质纳米颗粒(PNP),他们认为,这是一个比类病毒颗粒(VLP)更准确的名字。他们计划使用PNP递送各种基因药物,包括siRNA、ASO、mRNA和基因编辑组分,解决当前递送技术的局限,从而开发更广泛的基因药物,将基因药物的范围扩大到不同的组织和应用,从而使更多疾病领域的更多患者受益。
而在2024年1月,诺奖得主、加州大学伯克利分校Jennifer Doudna教授团队在Nature Biotechnology期刊发表论文【4】。

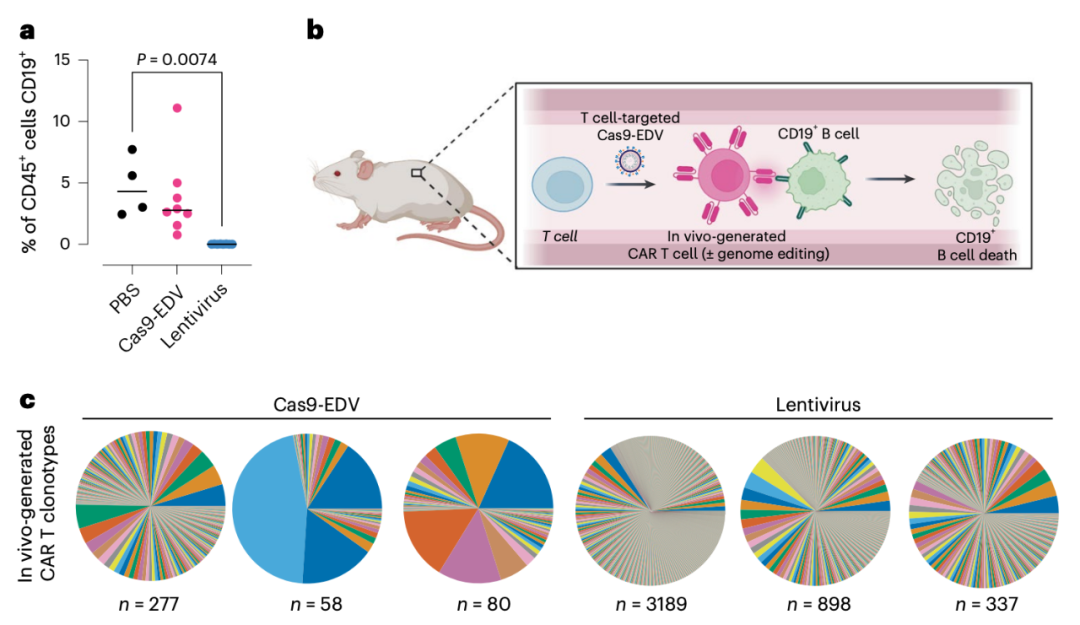
该研究开发了一种包膜递送载体(EDV),用来包装Cas9核糖核蛋白复合物(Cas9 RNP),构建了Cas9-EDV,可以在体外和体内实现对人类细胞特异性的基因组编辑。更重要的是,研究团队Cas9-EDV在具有人源化系统的小鼠体内直接生成了细胞,并且没有脱靶编辑。
VLP 解决当前递送技术的四大限制
递送载体通常可以分为病毒载体和非病毒载体,病毒载体以慢病毒(LV)和腺相关病毒(AAV)为主,非病毒载体以脂质纳米颗粒(LNP)为主。然而,它们都存在一些限制。
慢病毒载体具有感染分裂细胞和缓慢分裂细胞或非分裂细胞的能力、高效基因转导、低免疫原性,以及永久整合到宿主细胞基因组中并实现长期稳定基因表达的潜力。然而,由于其整合作用,可能具有潜在致。
腺相关病毒(AAV)载体是当前应用最广泛的体内基因递送载体,但其限制也非常明显,包括载体容纳有限、缺乏细胞靶向特异性、无法重复给药,此外,它被发现也具有整合和潜在致癌风险。
脂质纳米粒子(LNP)在新冠mRNA疫苗中得到了广泛应用,但其半衰期短,在体内的稳定性不足,体内递送效率差、载药效率低,易在肝脏富集,对肝外器官或细胞靶向性弱。
Nvelop 公司表示,其正在开发的两个VLP平台旨在从以下四个方面来解决当前递送技术的限制:
医药网新闻
- 相关报道
-
- 柳叶刀子刊:点名中国饮食,升糖指数最高,增加糖尿病风险 (2024-05-04)
- Genistin:一种新的雌激素类似物靶向ERβ缓解血小板减少症 (2024-05-04)
- Cell子刊:贾伟团队揭示肠道胆汁酸吸收增加导致年龄相关认知障碍 (2024-05-03)
- 卤键对蛋白质结构稳定性及其与多肽结合影响的计算研究获得进展 (2024-05-03)
- Circulation (2024-05-03)
- 祝贺!鲍哲南/冯国平/施扬/王贻芳等9名华人学者当选美国科学院院士/外籍院士 (2024-05-03)
- 最新医生收入报告出炉,哪个专业收入最高? (2024-05-03)
- 肠道菌群参与决定了你的MBTI?PNAS研究表明:肠道微生物群能够改变一个人的社交能力 (2024-05-03)
- 全球首创心肌肌球蛋白抑制剂迈凡妥®(玛伐凯泰胶囊)在中国获批,用于治疗梗阻性肥厚型心肌病成人患者 (2024-05-03)
- 刘如谦兑现承诺:首款先导编辑疗法IND获批,将开展1/2期临床试验 (2024-05-02)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















