Mol Cell |
 |

在本研究中,研究者运用na ve-poised-formative/Primed等干细胞模型,结合实验室先前在miRNA调控方面的研究基础,解释了驱动着床期胚胎形状建成的分子驱动力,主要内容概括如下:
1.DGCR8作为miRNA合成通路的核心蛋白,可以发挥不依赖于miRNA的转录抑制的非经典功能。在na ve mESCs中(代表着床前胚胎),DGCR8可以结合位于mRNA上短的茎环结构,招募并隔离转录激活子FLII,抑制转录进行。在Poised mESCs中(代表着床中胚胎),ERK通路瞬时激活,使得FLII受到磷酸化修饰并与DGCR8解离,进而与转录因子JUN结合并激活细胞迁移基因的转录。着床后ERK通路迅速失活(Formative mESCs),DGCR8重新结合并抑制FLII。因此DGCR8/FLII/JUN在ERK通路的介导下,在着床期特异地介导了一个瞬时转录激活事件的发生(图1)。
2.该转录激活事件控制了胚胎着床期由无序状态到极化状态的形态转变。且该事件在人和小鼠是保守的(图1)。
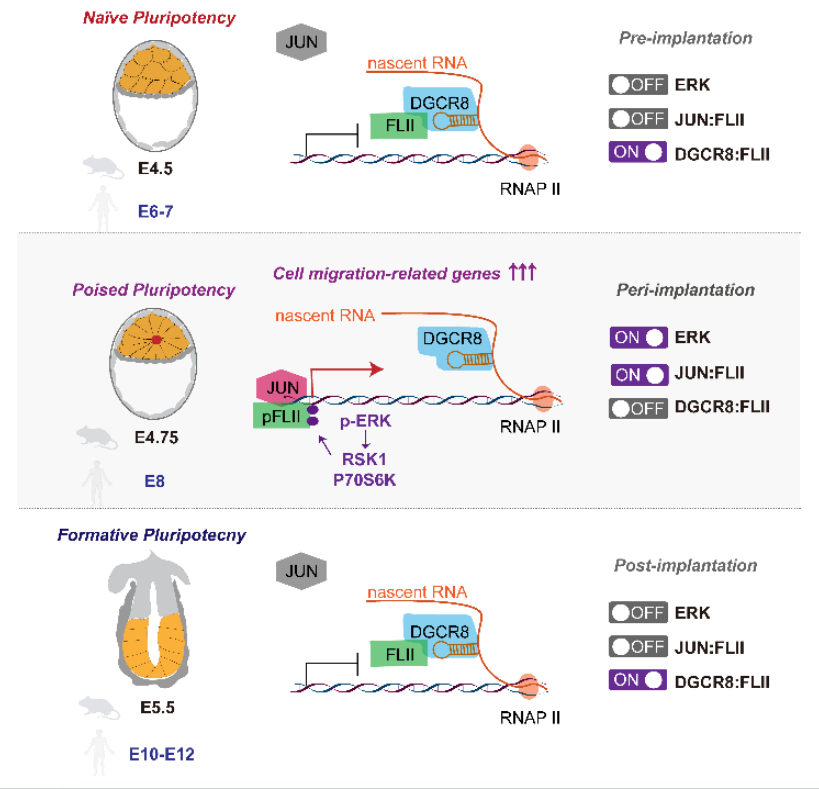
图1: 在着床前(naive)-着床中(Poised)-着床后(Formative)发育过程中,DGCR8/FLII/JUN在ERK通路调控下介导瞬时转录激活事件的发生,进而调控着床期胚胎形态转变。(Credit:Molecular cell)
本研究具体结论如下:
一:在na ve mESCs中, DGCR8通过结合mRNA上的茎环结构,招募并抑制转录激活子FLII。
基于前期的na ve小鼠胚胎干细胞中DGCR8互作蛋白数据/Co-IP/Pull down,作者发现,DGCR8与转录激活子FLII存在直接的蛋白相互作用。然而FLII并不参与miRNA合成通路。通过比较多种细胞系的转录组,作者发现传统的miRNA调控基因在敲除Dgcr8和Dicer这两个对于miRNA合成必需的基因后,由于miRNA整体缺失,都会出现整体上调的情况。另一大类基因只在Dgcr8敲除后上调,在Dicer敲除后则没有表型,这证明这部分基因不受miRNA的调控。在Dgcr8敲除的基础上敲除Flii(DF-dKO mESCs),这部分基因的上调被消除。综合其他结果说明:DGCR8和FLII共同在转录水平上控制了一组不受miRNA调控的基因,该类基因主要参与细胞迁移等活动,称为非miRNA靶向基因。DGCR8和FLII对于这类基因起到相反的调控作用,DGCR8抑制,而FLII则激活这类基因的表达。
为了进一步研究DGCR8如何抑制这类基因的转录,在na ve小鼠胚胎干细胞中,作者通过eCLIP实验鉴定了DGCR8/FLII的RNA结合靶点,同时在eCLIP实验中还掺入了S4U,可以同时鉴定出新生的RNA(nascent RNA)。作者发现DGCR8和FLII同时结合了大量的靶基因的新生mRNA,且DGCR8结合区域倾向于形成茎环结构。该茎环结构显著短于pri-miRNA上的茎环结构,并不能被DGCR8和DROSHA形成的复合体结合并切割。通过敲除DGCR8所结合的位于靶基因mRNA上的茎环结构,靶基因的转录抑制状态被解除。这证明DGCR8确实通过结合mRNA上的茎环结构来抑制转录。
综上,这说明DGCR8一方面和DROSHA结合负责pri-miRNA的切割,一方面结合在靶基因mRNA上的茎环结构,招募并抑制转录激活子FLII,从而抑制转录的进行。
二:FLII在na ve-poised-formative多能性转变过程中促进一组细胞迁移相关基因的激活及Poised多能性的建立。
在na ve-poised-formative(着床前 着床中 着床后)转变体系中,作者发现:与正常细胞相比,缺失FLII的细胞在该过程中逐渐死亡,说明FLII对于该过程是必需的。转录组分析发现:FLII的缺失并不影响细胞退出na ve多能性,而是特异的影响了Poised时期特异的细胞迁移相关基因的激活。进一步的,细胞也无法正常继续发育到formative多能性。综上结果说明:尽管FLII在na ve时期没有转录激活活性,但它在Poised时期重新获得了转录激活活性,并激活了一组细胞迁移相关基因的表达,促进Poised多能性的建立。这一过程对于随后转变到Formative多能性也是必需的。
三:FLII在Poised mESCs(代表着床期胚胎)中与DGCR8解离,并与转录因子JUN结合,激活Poised特异的细胞迁移基因。
特异地,FLII在Poised时期解除了与DGCR8的互作,同时也不再结合靶基因的mRNA 。这说明FLII与DGCR8的解离是FLII具有转录激活活性的关键条件。通过一系列生化实验,作者证明na ve-poised转变过程中,ERK通路瞬时激活,磷酸化FLII,使得FLII与DGCR8不再结合。同时磷酸化的FLII会与转录因子JUN互作增强。通过抑制MEK/ERK通路,DGCR8/FLII的解离得到阻止,而FLII/JUN的形成则被抑制。
为了进一步探究JUN是否和FLII一起促进了Poised多能性的建立,作者构建了Jun敲除与过表达的细胞系以探究JUN在多能性转变中的作用。结果发现: 与Flii类似,Jun的敲除同样影响了细胞迁移基因的激活,导致Poised多能性无法建立,并进一步影响到了formative多能性的建立。相反的是,Jun过表达显著增强细胞迁移基因的表达,并延长了其表达时间,最终导致Poised多能性的持续时间延长,阻止了进一步发育至formative多能性。
四:FLII促进JUN对DNA的结合,进而激活细胞迁移基因并建立Poised多能性。
作者进一步探究了FLII在JUN激活基因表达中的作用,作者在多种细胞系中进行了CUT Tag实验,结果发现: JUN广泛的结合在Poised时期激活的细胞迁移基因的启动子/增强子上,且Flii缺失后,JUN几乎完全丧失了DNA结合能力,此外,FLII过表达可以显著增强JUN的结合能力。以上结果说明FLII通过促进JUN对DNA的结合来实现转录激活作用。
五:Poised 多能性干细胞代表小鼠和人的着床期胚胎的上胚层细胞,这一时期的胚胎正经历无序到极化的形态转变。
通过与体内胚胎的转录组比较,作者发现Poised ESCs的转录组与小鼠与人的着床期胚胎转录组最为相似(小鼠为E4.75天,人为E8天)。这一时期胚胎的上胚层细胞逐渐从无序状态变成玫瑰花环样的极化结构。且在体外培养的着床期小鼠胚胎中,能够观察到JUN和其他静息态多能性标记基因的表达,进一步证明了已有结论。通过体外的模拟无序到极化的形态转变体系,作者发现抑制该转录激活事件都会导致无序到极化结构形态转变的失败。因此,本文中鉴定到的转录激活事件对应于着床期胚胎,而激活基因以细胞迁移相关基因为主,则对应着这一时期细胞的形态转变。
综上,该研究发现了DGCR8独立于miRNA之外的转录抑制功能,并与FLII/JUN一起,在ERK通路的控制下,控制了着床期的瞬时转录激活事件,进而控制这一时期的形态建成。
医药网新闻
- 相关报道
-
- 警惕“超级大肠杆菌”!它堵死肠道细胞“自我牺牲路”,新研究破解抗耐药密码 (2025-10-27)
- Nature Genetics:我们沿用20年的小鼠参考基因组,究竟错过了什么?一份T2T图谱的完整答案 (2025-10-26)
- 情感传染!南方医科大学最新论文登上Science封面 (2025-10-26)
- Nature Biotechnology:数据基准与算法创新的双轮驱动——DeepSomatic研究定义的基因组学发现新范式 (2025-10-25)
- Nature:当饥饿遇上荷尔蒙——大脑如何权衡母爱与生存? (2025-10-25)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 《柳叶刀》:减肥神药,暗藏护心秘法!迄今最大规模临床试验证实,司美格鲁肽的心脏保护作用与基线肥胖和体重减轻无关,或有独特保护机制 (2025-10-24)
- Cell子刊:脂肪细胞脂解,激活上皮干细胞,促进毛发再生 (2025-10-24)
- AJPCP:线粒体钾通道调节棕色脂肪组织的产热,为新的肥胖治疗铺平道路 (2025-10-24)
- 生育力下降别只怪卵子!Science:卵巢里的神经、胶质细胞才是“隐形操控者” (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















