Nature : 破解DNA复制的密码!人类MCM双六聚体加载机制的首次全面解析 |
 |

DNA复制:从酵母到人类的科学进化
DNA复制的起始,需要多个蛋白质复合体的紧密协作。起始识别复合体(ORC),相当于 指挥官 ,负责招募其他因子;CDC6与CDT1,像是 工程师 ,帮助安装MCM复合体;MCM2 7,DNA解旋的 工具 ,加载为头对头的双六聚体,确保两条新链复制同步。
然而,人类细胞与酵母有着显著不同。
复制起始点的灵活性:酵母的复制起始点依赖严格的DNA序列,而人类细胞则几乎不挑剔;
加载调控的复杂性:酵母的ORC6是必需因子,但在人类中,它的作用竟然可被替代。
这些特性让人类MCM加载的机制显得扑朔迷离,也为研究人员提出了一个核心问题:人类细胞如何在这看似混乱的起始点中,确保DNA复制的进行?
研究方法:还原DNA复制的分子拼图
为了揭示人类MCM加载的奥秘,研究人员设计了一套巧妙的实验方案:
蛋白表达与制备
使用杆状病毒系统分别纯化了ORC1 5、ORC6、CDC6、CDT1和MCM2 7蛋白。实验发现ORC6无法与其他ORC蛋白共纯化,需单独制备;CDT1与MCM也需分离表达,以防非特异性结合。
研究团队进一步制备了去除N端非结构化区域(IDR)的突变蛋白,以避免非特异性液液相分离现象对实验结果的干扰。
核酸酶保护实验
想象一片DNA像是河流,加载的蛋白像桥梁。核酸酶保护实验通过降解未被保护的DNA区域,精确标记 桥梁 保护的范围。初始阶段,加载的MCM形成约75 bp的保护片段;完成阶段,保护片段缩短至55 bp,显示额外接触区域的消失。
冷冻电子显微镜(Cryo-EM)
冷冻电镜技术提供了原子级别的分辨率,帮助研究人员直接观察到人类微管状复制复合体的双六聚体(human MCM Double Hexamer,hDH)加载的分子结构,包括六聚体之间的结合方式、DNA解旋的精细过程及ATP酶的活性位点分布。
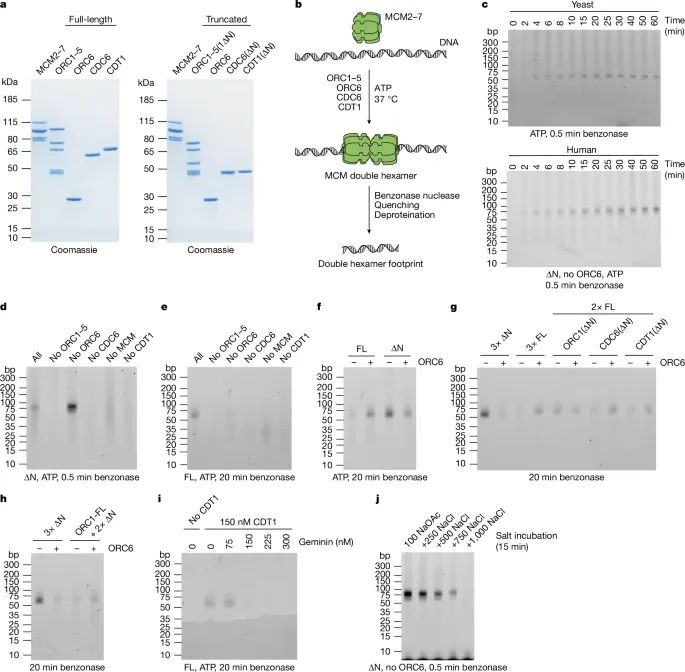
人类MCM双六聚体(hDH)加载的重构实验(Credit:Nature)
该图展示了重建人类MCM双六聚体加载过程的实验设计、关键技术和主要结果,具体分为以下几个部分:
蛋白纯化和检测(图a)实验中使用了全长蛋白和N端非结构域(IDR)删除突变蛋白(∆N蛋白),包括:ORC1 5复合体(含ORC1(∆N)),CDC6(∆N)和CDT1(∆N)。纯化的蛋白通过SDS-PAGE电泳分离后用考马斯蓝染色,左侧为全长蛋白,右侧为∆N突变蛋白,显示各蛋白的纯度和表达情况。结果验证了重组蛋白的制备质量,确保后续实验的可靠性。
核酸酶保护实验用于检测MCM加载过程中DNA与蛋白复合物的结合区域。实验中:加载反应后用Benzonase酶切处理去除未保护的DNA;用EDTA、SDS和蛋白酶K终止反应;通过苯酚-氯仿-异戊醇提取纯化剩余DNA;将DNA分离后通过TBE聚丙烯酰胺凝胶电泳分析,并用SYBR Gold染色检测。
时间依赖性实验(图c)对比了酵母和人类MCM加载反应的时间依赖性,分为两组:上图(酵母MCM加载),加载过程中,保护的DNA片段在2-4分钟时开始形成,最终长度约为55 bp。下图(人类MCM加载),类似地,在∆N突变蛋白条件下,人类MCM加载产生了约75 bp的保护片段,随后逐渐缩短为55 bp。这表明两者在加载过程中均表现出时间依赖性,但人类系统存在更广泛的初始接触区域。
∆N蛋白与全长蛋白的比较(图d和e)图d,∆N突变蛋白的核酸酶保护实验,逐步去除关键蛋白(如ORC6、CDC6、CDT1)后观察保护片段的变化。结果表明,缺失ORC6对hDH加载影响较小。图e,全长蛋白条件下的实验,显示ORC6存在时加载效率略高,但并非绝对必需。
全长与∆N蛋白的依赖性差异(图f)对比了全长蛋白和∆N蛋白在加载过程中对ORC6的依赖性。结果表明:在全长蛋白条件下,ORC6促进了加载;而在∆N突变蛋白条件下,ORC6的加入反而抑制了加载。
不同蛋白截短对加载的影响(图g和h)图g,分别截短ORC1、CDC6和CDT1后,发现ORC1的N端非结构化区域(IDR)是ORC6依赖加载路径的必要因素。图h:使用全长ORC1与截短的CDC6和CDT1,进一步验证了ORC1 IDR在ORC6依赖路径中的关键作用。
Geminin对加载的抑制作用(图i)Geminin是一种在细胞周期中抑制MCM加载的蛋白,通过与CDT1结合发挥作用。实验显示,当Geminin浓度等于或超过CDT1时,MCM加载显著被抑制。这表明Geminin通过阻断CDT1功能有效阻止了hDH的形成。
加载后的盐稳定性(图j)加载30分钟后,用不同浓度的氯化钠(NaCl)处理hDH复合物,观察其稳定性。在500 mM NaCl条件下,hDH保持稳定;而在750 mM NaCl以上,hDH逐渐解离。相比之下,酵母MCM双六聚体在高达2 M NaCl中依然稳定,表明人类hDH对高盐浓度的耐受性较低。
实验发现:MCM加载的分子奥秘
加载是一个动态过程
通过核酸酶保护实验,研究人员首次揭示了hDH加载的时间依赖性:在加载的初始阶段(2分钟),MCM与DNA形成广泛接触,保护片段长度达75 bp;随着加载的完成(20分钟后),保护片段缩短至55 bp,与hDH中心通道的理论保护长度一致。
这种动态变化不仅是加载过程完成的标志,更揭示了额外接触区域的逐步解离。
DNA解旋与稳定机制
冷冻电镜结构显示,hDH加载过程中,两六聚体间的5个碱基对发生解旋(underwound),并断裂一个碱基对。断裂的碱基对由MCM5亚基的两个关键氨基酸稳定。R195,通过正电荷吸引孤碱基。L209:通过疏水作用进一步固定。
突变实验表明,这两个氨基酸并非DNA解旋的必要条件,但在稳定解旋后的DNA状态中至关重要。突变体加载的hDH在DNA上更加 滑动 ,反映了这些位点在加载后固定DNA的作用。
ORC6参与但非必需:加载路径的灵活性
研究揭示了两条加载路径。非依赖路径,去除ORC6后,MCM依然能够高效加载。这一路径在IDR去除突变的蛋白中更为显著。依赖路径,ORC6通过与ORC1的N端非结构域(IDR)相互作用,促进了加载效率。当ORC1的IDR被删除时,ORC6的加载促进作用完全丧失。
ATP驱动:加载的核心动力
MCM加载的驱动力来自ATP水解。MCM的ATP结合位点以特定模式分布,MCM6 MCM2界面结合ATP,其余亚基结合ADP。当ATP被非水解型模拟物ATP S替代时,仅能形成初始加载中间体,无法完成加载。
盐浓度影响稳定性
加载后的hDH在500 mM NaCl条件下表现稳定,而750 mM NaCl会导致其逐渐解离。相比之下,酵母的双六聚体在2 M NaCl中依然稳定,显示人类加载机制可能更加灵活但稳定性略逊。
从分子到生命:MCM加载机制的生物学意义
基因组稳定性的守护者DNA复制起始的精确性直接影响基因组稳定性。MCM加载的多路径机制为人类细胞提供了冗余调控,降低了因单路径故障导致复制失败的风险。
癌症治疗的潜在靶点异常的MCM加载与多种癌症密切相关。研究揭示的ORC6依赖与非依赖路径为开发新型抗癌药物提供了方向,例如通过靶向调控ORC1 IDR的作用。
DNA复制机制的进化视角与酵母严格依赖DNA序列的加载不同,人类MCM加载表现出非特异性和路径多样性,这种灵活性或许是复杂基因组对进化压力的适应。
该研究首次为人类MCM加载机制提供了详尽的分子解析,揭示了其动态性、灵活性和调控特性。下一步研究或将尝试重建更完整的人类DNA复制起始复合体,探索加载后的复制叉形成和调控机制。这不仅是基础科学的延续,也将为精准医学和基因编辑技术带来全新契机。
生命的复杂性,往往体现在那些看似细微的分子事件中。通过解开DNA复制的奥秘,我们离理解生命本身又近了一步。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 气温"断崖式"下跌!广州人除了添衣物,更重要的是…… (2025-10-24)
- HICOOL 2025峰会聚焦:签约央企国家队、首发新品、启动国际联合体,国典医药奏响再生医学“三重奏” (2025-10-23)
- 2025年福建省药品检验技能比武圆满收官 (2025-10-23)
- 引领医药项目管理迈向新高度--第二届中国医药企业项目管理大会定于11月在京召开 (2025-10-23)
- 牙周炎伴牙龈萎缩:8款医用级修复解决方案权威推荐 (2025-10-23)
- 辽宁:2025年11月1日起全面完成生养津贴发放至团体 (2025-10-23)
- 放射科与分研院联合研究成果发表于Science子刊,为动脉粥样硬化诊疗开辟新路径 (2025-10-23)
- 用药更少、服用更不便:我国幽门螺杆菌根除医治研讨取得新突破 (2025-10-23)
- 醉酒后光止吐没用!GFX 护肝胶囊用实力护肝脏 (2025-10-23)
- Nat Biotechnol:给免疫细胞“写记忆”!科学家发明不伤DNA的基因开关,抗癌能力有望持久升级 (2025-10-23)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















