放疗后口腔鳞癌的“微小囊泡”藏抗瘤关键!Int J Radiat Biol揭示miR-198-5p/MYD88调控巨噬细胞新机制 |
 |
放疗后口腔鳞癌的“微小囊泡”藏抗瘤关键!Int J Radiat Biol揭示miR-198-5p/MYD88调控巨噬细胞新机制
来源:100医药网 2025-09-22 16:00
本研究发现,辐射处理的口腔鳞状细胞癌细胞分泌的富含微小RNA-198-5p的细胞外囊泡,可通过靶向髓样分化因子88抑制巨噬细胞向M2型极化,为口腔鳞癌治疗提供新策略。作为头颈部高发,其中口腔鳞状(OSCC)因侵袭性强、预后较差,成为临床治疗的重点难题。目前,肿瘤切除术后辅助放疗是OSCC的主要治疗方案之一,但放疗抵抗现象频发,严重制约治疗效果,如何提升放疗敏感性、改善肿瘤微环境,成为科研人员关注的核心方向。
近期,发表在Int J Radiat Biol的一项研究Extracellular vesicles derived from irradiated oral squamous cell carcinoma cells inhibits M2 macrophage polarization by the miR-198-5p/MYD88 axis,从放疗后释放的细胞外囊泡(EVs)入手,深入解析其对巨噬细胞极化的调控机制,为OSCC的治疗突破提供了全新思路。

研究首先针对辐射剂量进行优化,对SCC-9和Cal27两种OSCC细胞系施加0、2、4、8Gy的X射线照射,通过CCK8实验发现,4Gy与8Gy照射对细胞活力的抑制效果相近,且能有效诱导细胞响应,因此确定4Gy为后续实验的辐射剂量。随后,研究人员从辐射处理后的OSCC细胞上清中分离出EVs,经透射电子显微镜观察到直径80-150nm的囊泡结构,动态光散射分析显示其平均直径约114nm,Western blot进一步验证了EVs特异性标志物HSP70和CD63的阳性表达,证实了EVs的成功分离。更关键的是,通过RT-qPCR检测发现,与正常培养的OSCC细胞释放的EVs(NC-EVs)相比,辐射诱导的EVs(IR-EVs)中微小RNA-198-5p(miR-198-5p)的表达水平显著升高,提示该微小RNA可能在辐射调控EVs功能中发挥核心作用。
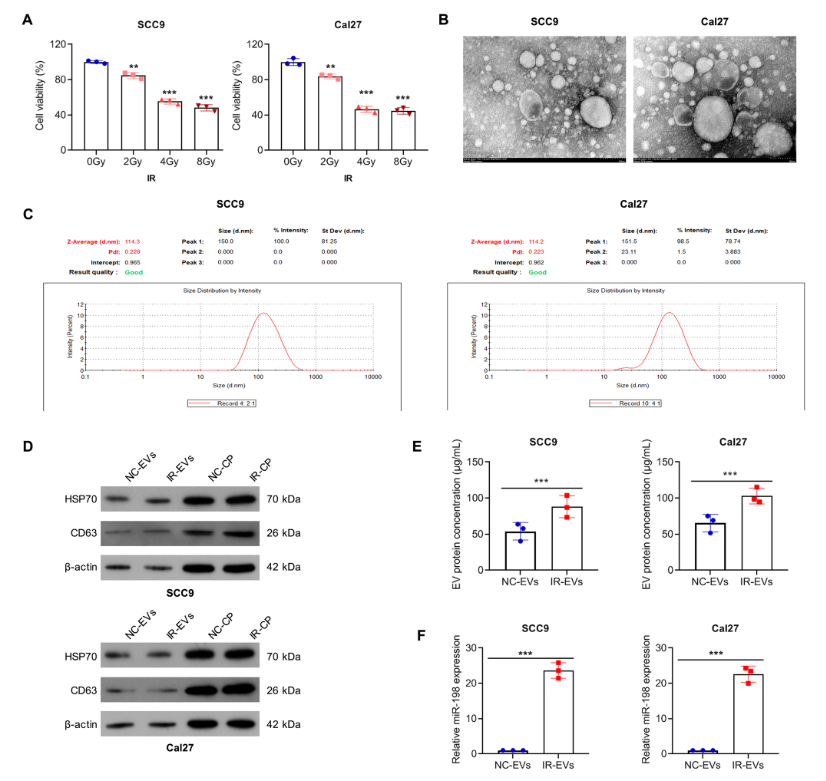
图1:电离辐射暴露后口腔鳞状细胞中微小RNA-198-5p的表达增加
为探究IR-EVs与巨噬细胞的相互作用,研究将THP-1细胞用PMA诱导分化为M0型巨噬细胞(光镜下可见细胞从悬浮小圆状变为贴壁大细胞,CD68阳性率从0.07%升至99.96%),并与荧光标记的EVs共培养。结果显示,巨噬细胞可有效摄取NC-EVs和IR-EVs,且经IR-EVs处理的巨噬细胞中,miR-198-5p的表达水平较NC-EVs处理组和对照组显著升高,明确了OSCC细胞可通过EVs将miR-198-5p传递至巨噬细胞内。
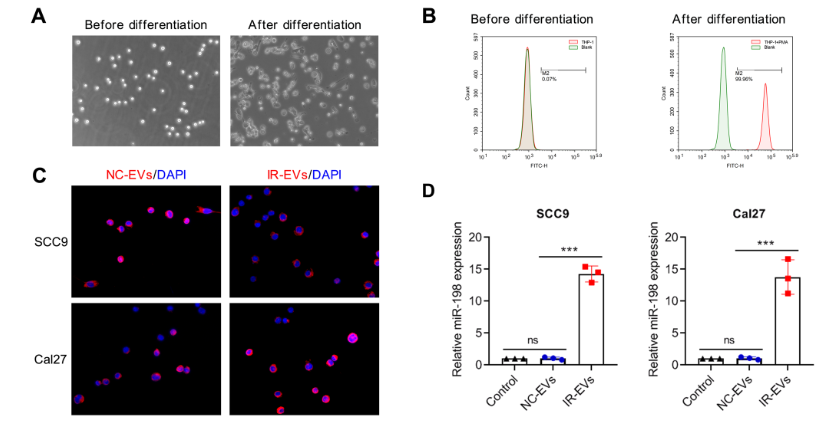
图2:口腔鳞状细胞癌细胞通过细胞外囊泡将微小RNA-198-5p传递给巨噬细胞
进一步研究IR-EVs对巨噬细胞极化的影响,流式细胞术结果显示,与NC-EVs相比,IR-EVs处理可显著上调巨噬细胞中M1型标志物CD86的表达,同时下调M2型标志物CD206的表达;荧光染色也观察到类似趋势;Western blot检测发现,IR-EVs处理组的M1型标志物CD80蛋白水平升高,而M2型标志物Arg-1、CD163的蛋白水平降低;ELISA检测细胞上清显示,IR-EVs可促进促炎细胞因子IL-12的分泌,抑制抗炎细胞因子IL-10的分泌。这些结果共同证实,IR-EVs能有效促进巨噬细胞向抗瘤的M1型极化,抑制促瘤的M2型极化。
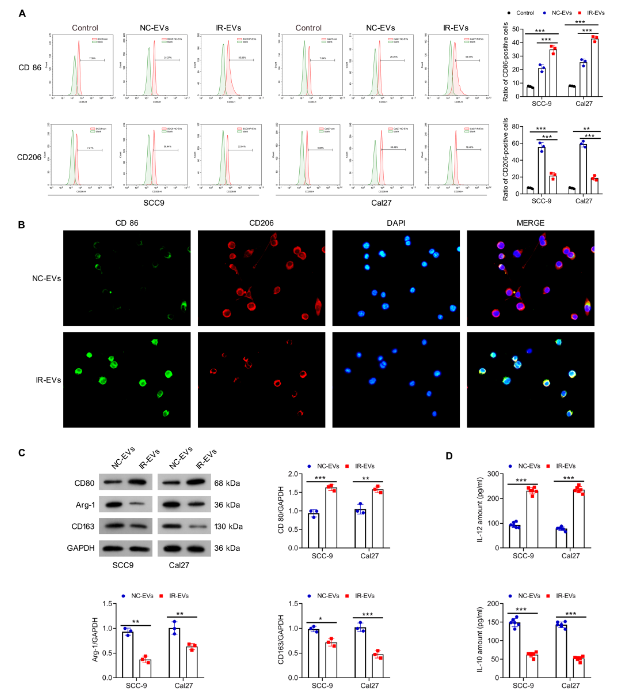
图3:辐射诱导的细胞外囊泡促进巨噬细胞向M1型极化
为明确miR-198-5p调控巨噬细胞极化的分子靶点,研究通过TargetScanHuman 7.2数据库预测,发现髓样分化因子88(MYD88)可能是miR-198-5p的潜在靶标。双荧光素酶报告基因实验显示,转染miR-198-5p模拟物可显著降低含MYD88野生型3 UTR质粒的荧光素酶活性,而对突变型质粒无影响,证实miR-198-5p可直接结合MYD88的3 UTR。此外,向巨噬细胞转染miR-198-5p模拟物可降低MYD88的表达,转染抑制剂则升高MYD88的表达,进一步验证了miR-198-5p对MYD88的靶向抑制作用。
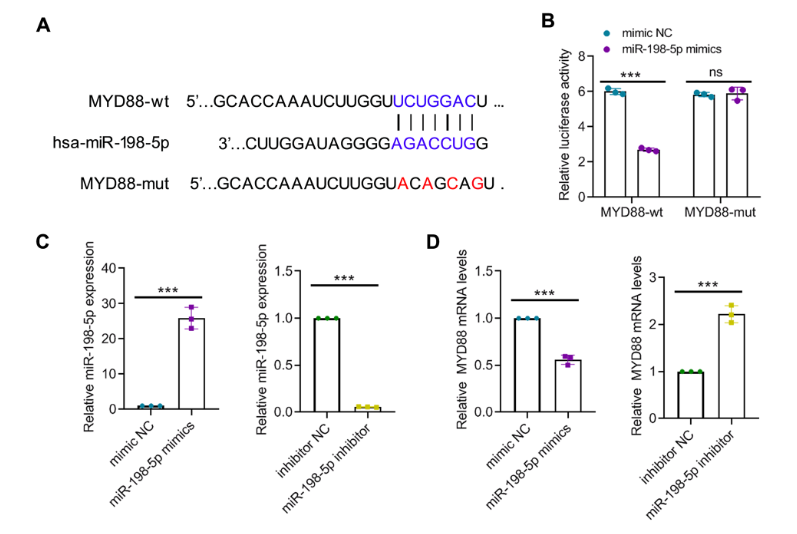
图4:髓样分化因子88是微小RNA-198-5p的潜在靶标
为验证MYD88在IR-EVs调控巨噬细胞极化中的作用,研究构建MYD88过表达质粒并转染巨噬细胞。结果显示,过表达MYD88后,即使经IR-EVs处理,巨噬细胞中IL-12的分泌量仍降低,IL-10的分泌量升高;流式细胞术显示CD86表达下调、CD206表达上调;Western blot显示CD80蛋白水平降低,Arg-1、CD163蛋白水平升高。这表明,过表达MYD88可逆转IR-EVs对巨噬细胞极化的调控作用,进一步证实IR-EVs通过miR-198-5p靶向抑制MYD88,从而调控巨噬细胞极化。
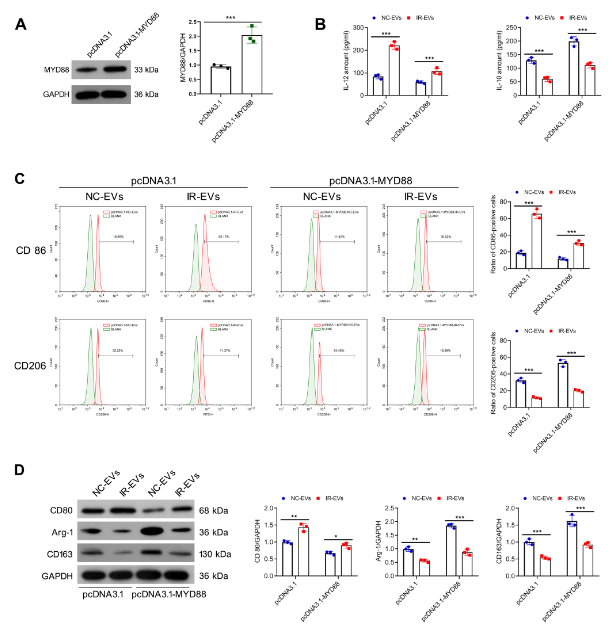
图5:髓样分化因子88过表达可逆转辐射诱导的细胞外囊泡介导的巨噬细胞M2型极化抑制
综上,这项研究系统揭示了放疗后OSCC细胞释放的EVs的关键作用:辐射诱导OSCC细胞分泌富含miR-198-5p的EVs,这些EVs被巨噬细胞摄取后,通过靶向抑制MYD88的表达,促进巨噬细胞向M1型极化、抑制M2型极化,从而改善肿瘤微环境的抗瘤免疫状态。这一发现不仅为理解放疗后肿瘤微环境的重塑机制提供了新视角,更提示将miR-198-5p封装进EVs可能成为OSCC的新型免疫治疗策略,为临床提升OSCC放疗效果、攻克放疗抵抗难题提供了重要的理论支撑和潜在靶点。(100yiyao.com)
参考文献:
Du X, Duan M, Zhang Y, Li R. Extracellular vesicles derived from irradiated oral squamous cell carcinoma cells inhibits M2 macrophage polarization by the miR-198-5p/MYD88 axis.Int J Radiat Biol. Published online September 16, 2025. doi:10.1080/09553002.2025.2498981
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Cancer Cell:浙江大学梁廷波团队发布序贯新辅助化疗方案治疗胰腺癌的3期临床数据 (2025-10-12)
- 广州国家实验室论文登上Cell Stem Cell封面:成功构建高保真人类着床后胚胎模型 (2025-10-12)
- 15亿美元,BMS收购一家in vivo CAR-T公司,诺奖得主与华人学者联合创立,利用环状RNA在体内生成CAR-T细胞 (2025-10-12)
- 法瑞西单抗引领眼底治疗进入“长效时代” (2025-10-12)
- Science:抗癌新策略!科学家实现“精准拆弹”,直击癌基因“指挥中心” (2025-10-11)
- 研究提出氨基酸理化性质趋同新方法 (2025-10-11)
- Brief Bioinform:AI显微镜!新算法让免疫细胞“开口说话”,精准度超93%! (2025-10-11)
- JAMA Psych:汽水喝多了,抑郁风险高?科学家发现肠道细菌是“隐形推手”! (2025-10-11)
- 华东师范大学丽娃皮肤健康研究院 | 关于举办“损容性皮肤病及医美”稳态管理创新人才高级培训班的通知 (2025-10-11)
- Nature:吸烟和性别如何“雕刻”你的膀胱?科学家在健康组织中找到癌症风险线索 (2025-10-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















