CAR |
 |
来源:100医药网原创 2023-07-31 20:19
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性和非霍奇金的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.
doi:10.1126/scitranslmed.add7900
在一项新的研究中,来自美国马里兰大学医学院的研究人员设计出了一种新型 CAR-T 细胞疗法,在临床前研究中,这种细胞疗法能选择性地攻击癌细胞,同时保护健康细胞,从而降低了这种创新癌症疗法产生毒副作用的可能性。这些CAR-T 细胞专为攻击多发性骨髓瘤而设计,多发性骨髓瘤是一种存在于人体骨髓中的浆细胞癌症。相关研究结果发表在2023年7月19日的Science Translational Medicine期刊上,论文标题为 Systematic single amino acid affinity tuning of CD229 CAR T cells retains efficacy against multiple myeloma and eliminates on-target off-tumor toxicity 。
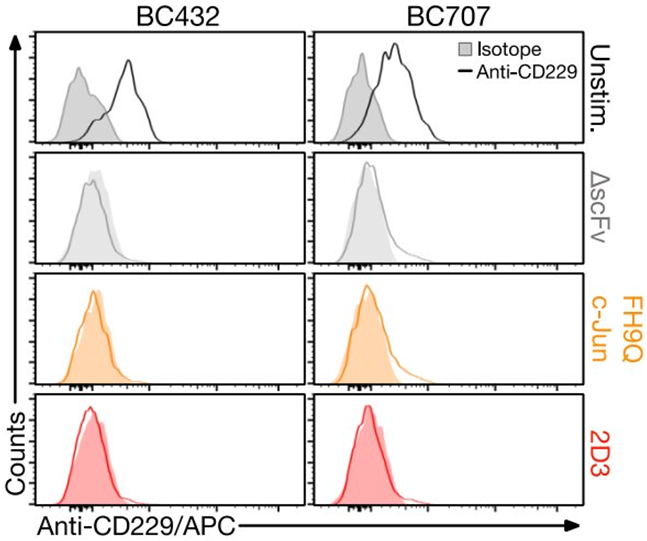
CD229在CAR-T细胞中的表达。在CAR-T细胞生产第9天,通过流式细胞术检测CD229在CAR-T细胞产品表面上的表达,以及来自两名健康人类供体的未刺激T细胞的表达。图片来自Science Translational Medicine, 2023, doi:10.1126/scitranslmed.add7900。
论文通讯作者、马里兰大学医学院微生物学与免疫学助理教授Tim Luetkens博士说, 我们在临床前研究中清楚地看到,这种新疗法能有效地消灭肿瘤细胞,而不会攻击健康细胞。我们非常看好它作为一种更安全的新型癌症疗法的潜力。
在此前发表在Nature Communications期刊上的一项研究中,Luetkens 博士、马里兰大学医学院医学教授 Djordje Atanackovic 博士和威斯康星医学院助理教授 Sabarinath Radhakrishnan 博士开发了一种新的 CAR T 细胞疗法,它靶向攻击的蛋白与目前的 CAR-T 细胞疗法不同(Nature Communications, 2020, doi:10.1038/s41467-020-14619-z)。他们决定把重点放在一种名为 CD229 的蛋白上,这种蛋白在多发性骨髓瘤癌细胞中非常普遍,而在健康细胞中则不常见。然而,他们证实,CD229 CAR-T 细胞仍然会攻击一些健康的血细胞,这是一种潜在的严重毒副作用。
在这项新的研究中,Luetkens 博士和他的同事们旨在利用一种称为亲和力调整(affinity tuning)的复杂方法,设计出只攻击恶性肿瘤细胞而不攻击健康细胞的 CD229 CAR-T 细胞。他们交换了单个氨基酸,测试了305种不同的变体,煞费苦心地确定了最佳的CAR-T细胞序列,以达到最佳效果:容易识别癌细胞,同时忽略健康细胞。
最初,这些作者失望地发现,他们设计出的优化 CAR受体显然会导致 CAR-T 细胞生长得更慢。从理论上讲,这种缓慢的生长可能会导致这种细胞疗法对患者的疗效不佳。他们采用了斯坦福大学研究人员之前开发的一种新方法(Nature, 2019, doi:10.1038/s41586-019-1805-z),从而克服了这一障碍。
2.
doi:10.1016/j.cell.2023.06.002
利用工程化的T细胞来破坏癌细胞目前在治疗某些类型的癌症上已经表现出了成功,比如白血病和淋巴瘤,然而,其对于实体瘤的治疗效果并不理想。而缺乏成功的原因之一在于T细胞仅能靶向作用一种抗原(肿瘤上发现的靶向性蛋白),如果某些肿瘤细胞不表达这种抗原的话,其就会逃避T细胞的攻击。近日,一篇发表在国际杂志Cell上题为 Vaccine-boosted CAR T crosstalk with host immunity to reject tumors with antigen heterogeneity 的研究报告中,来自MIT等机构的科学家们通过研究发现了一种克服这一障碍的方法,其能利用一种疫苗来增强名为嵌合抗原受体(CAR)T细胞的工程化T细胞的反应,同时还能帮助免疫系统产生新的T细胞从而靶向作用其它的肿瘤抗原;在对小鼠进行的研究中,研究人员发现,这种方法或许会使得肿瘤更有可能被根除。
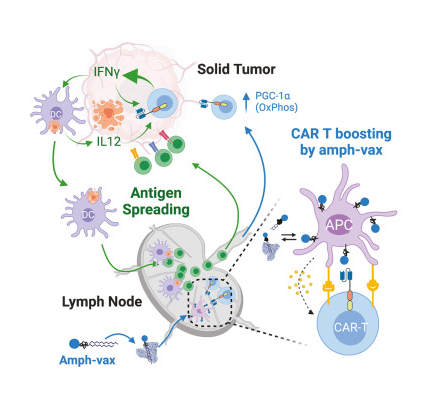
一种疫苗增强的工程化T细胞反应或能帮助清除人类的实体瘤。图片来源:Cell(2023). DOI:10.1016/j.cell.2023.06.002
研究者Darrell Irvine教授说道,这种疫苗的增强似乎能驱动一种名为抗原扩散(antigen spreading)的过程,在该过程中,机体自身的免疫系统就能与工程化的CAR T细胞合作从而拒绝那些并非所有细胞都表达被CAR T细胞所靶向作用的抗原的肿瘤。目前批准了多种T细胞疗法来治疗血液癌症,这些疗法都是基于CAR-T细胞,其能被工程化改造来展示受体从而识别癌细胞上存在的特殊抗原。
为了尝试将这种疗法应用到胶质母细胞瘤(一类脑癌)中,研究人员设计了CAR-T细胞来靶向作用EGFR受体的一个突变版本,然而,并非所有的胶质母细胞瘤细胞都会表达这种抗原,而且当其被CAR-T细胞攻击时,有些胶质母细胞瘤细胞就会通过停止靶向性抗原的产生来产生反应。在2019年的一项研究中,研究者Irvine及其同事通过在使用工程化T细胞后不久将疫苗直接输注到小鼠体内来增强CAR-T细胞抵御胶质母细胞瘤的疗效,这种携带被CAR-T细胞靶向作用的相同抗原的疫苗就会被淋巴结中的免疫细胞所摄取,而CAR-T细胞则会在淋巴结中接触到它。
这项研究中,研究人员发现,这种疫苗的提升不仅能帮助工程化的CAR-T细胞攻击肿瘤,还会产生另一种意想不到的效应,其或许还有助于产生靶向作用其它肿瘤抗原的宿主T细胞。这种被称之为 抗原扩散 (antigen spreading)的现象是可取的,因为其能产生一类特殊的T细胞群,当其在一起发挥作用时就能完全根除肿瘤病预防肿瘤再生。研究者Irvine表示,这或许正是能帮助你处理实体瘤中抗原异质性的东西,因为如果让宿主T细胞来攻击其它抗原,其就能够进来并杀灭CAR-T细胞无法杀灭的肿瘤细胞。
3.
doi:10.1016/S0140-6736(23)01052-8
一项新的临床试验表明单次输注嵌合抗原受体T细胞(CAR-T)疗法可诱导复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者完全缓解。相关研究结果近期发表在Lancet期刊上,论文标题为 Lisocabtagene maraleucel in chronic lymphocytic leukaemia and small lymphocytic lymphoma (TRANSCEND CLL 004): a multicentre, open-label, single-arm, phase 1 2 study 。
论文共同作者、美国西北大学医学教授Shuo Ma博士说, CAR-T细胞疗法利用患者自身的免疫细胞来对抗癌症。这种新型细胞免疫疗法是治疗复发性B细胞淋巴瘤的一大进步。我们在这项临床试验中报告了CAR-T细胞疗法Liso-cel治疗CLL/SLL的首个多中心研究。
在这项新的临床研究中,这些作者旨在评估CAR- T细胞疗法---特别是lisocabtagene maraleucel(liso-cel)---的疗效和安全性,该疗法用于治疗117例复发或难治性CLL或SLL成人患者,这些患者此前平均接受过5种疗法。CAR-T细胞疗法利用经过基因增强的T细胞更有效地定位和消灭癌细胞。
在这项临床试验中,所有患者都接受了两种剂量水平之一的liso-cel一次性静脉输注。Ma说,在49名接受高剂量治疗的双重难治性CLL/SLL患者中,总反应率为47%,完全缓解率为18%,与0~5%的历史反应率相比,明显更高。
这些作者说,缓解时间约为一个月,而且在获得完全缓解的患者中,没有人在20个月的随访中复发,这表明这种缓解具有持久性。
4.
doi:10.1016/S1474-4422(23)00194-1
来自一项小规模临床试验的证据表明,一种称为CAR-T细胞的先进血癌免疫疗法的改进形式经调整后可能能够用于治疗重症肌无力(myasthenia gravis),即一种神经系统的自身免疫性疾病。这项临床试验使用的改良型CAR-T疗法提供了更持久地减少重症肌无力症状的潜力,而且耐受性良好,没有明显的不良反应。相关研究结果发表在2023年7月的Lancet Neurology期刊上,论文标题为 Safety and clinical activity of autologous RNA chimeric antigen receptor T-cell therapy in myasthenia gravis (MG-001): a prospective, multicentre, open-label, non-randomised phase 1b/2a study 。

美国国家神经病与中风研究所小型企业项目主任Emily Caporello博士说, 重新利用CAR-T这样的突破性疗法来治疗一种神经系统疾病,显示了免疫疗法在治疗方案有限甚至没有的情况下的多功能性。
在这项新的研究中,14名全身性重症肌无力患者接受了不同剂量的称为Descartes-08的改良型CAR-T细胞疗法,这种细胞疗法靶向负责产生导致重症肌无力的抗体的细胞。理想的剂量被确定为每周一次,为期六周。
关于这种细胞疗法有效性的早期数据是有希望的,但还需要更多的临床研究来评估该疗法的疗效。接受Descartes-08治疗的三名患者显示他们的症状完全或接近完全消除,这种情形在治疗后持续了六个月。另外两名患者不再需要接受目前针对一些严重的重症肌无力病例的长期静脉注射免疫球蛋白。
5.
doi:10.1056/NEJMoa2300709
作为英国伦敦大学学院(UCL)和大奥蒙德街儿童医院(GOSH)之间 从实验室到临床 合作的一部分,三名患有复发T细胞白血病的年轻患者如今接受了经过碱基编辑的CAR-T细胞的治疗。这项初步的临床试验的数据表明供者CAR-T细胞如何利用前沿的基因编辑技术进行基因改造从而改变它们的DNA代码中的单个碱基,以便它们能够对抗白血病。相关研究结果于2023年6月14日在线发表在NEJM期刊上,论文标题为 Base-Edited CAR7 T Cells for Relapsed T-Cell Acute Lymphoblastic Leukemia 。
作为这三名患者中的一员,来自英国莱斯特市的13岁的Alyssa是去年世界上第一个因患有T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia, T-ALL)而参与这项临床试验的人。T-ALL是一种白细胞癌症,通常用化疗来治疗,但如果它复发,就很难清除。
在接受这种经过碱基编辑的CAR-T细胞治疗后的四周内,Alyssa的白血病就检测不出来了,她接着成功地进行了骨髓移植,在将近一年后,她仍然健康在家。
第二位参加这项临床试验的青少年在类似的时间段内清除了体内的白血病,如今他们在接受这种经过碱基编辑的CAR-T细胞移植后正在家里康复。遗憾的是,虽然第三名参加这项临床试验的孩子对这种经过碱基编辑的CAR-T细胞疗法有反应,但其病程因严重感染而变得复杂,这名孩子的家人与临床团队达成一致,转为缓和照顾(palliative care)。
6.
doi:10.1093/noajnl/vdad024
弥漫内生型脑桥胶质瘤(Diffuse Intrinsic Pontine Glioma, DIPG)通常发生在5至7岁的儿童身上,是一种侵袭性的脑瘤,每年影响澳大利亚的20名儿童。这种快速生长的肿瘤形成于儿童大脑中负责呼吸、吞咽和运动等重要功能的部分,这意味着它无法通过手术切除。被为DIPG的儿童不可能在诊断后存活一年,目前没有治疗这种毁灭性疾病的方法。

图片来自Neuro-Oncology Advances, 2023, doi:10.1093/noajnl/vdad024。
在一项新的研究中,来自澳大利亚沃尔特和伊丽莎-霍尔医学研究所(WEHI)等研究机构的研究人员发现,用一种创新的新型免疫疗法---CAR-T细胞疗法---来治疗DIPG是有希望的。他们指出CAR-T细胞疗法对DIPG肿瘤具有有效的靶向作用。相关研究结果于2023年5月4日发表在Neuro-Oncology Advances期刊上,论文标题为 HER2 chimeric antigen receptor T cell immunotherapy is an effective treatment for diffuse intrinsic pontine glioma 。
在WEHI实验室负责人Misty Jenkins副教授的领导下,这些作者发现在临床前模型中,这些经过特别设计的CAR-T细胞能够进入大脑,并通过减少肿瘤负荷而产生抗癌效果。
Jenkins说, 与放疗不同,放疗既能杀死癌细胞,也能杀死健康的脑组织,而CAR-T细胞疗法使用患者自身的免疫细胞,并对它们进行基因改造以识别和杀死肿瘤。CAR-T细胞提供了一种治愈的可能性,没有长期的副作用。这些经过基因修饰的CAR-T细胞作为一种 活的药物 起作用,这意味着患者将在体内保留抗肿瘤反应的活记忆,如果肿瘤再次复发,也可能起到杀死肿瘤的作用。这些细胞可以完全消除肿瘤,并在未来持续存在于体内,这是CAR-T细胞疗法令人兴奋的地方,也是免疫疗法是医学未来的原因。
7.
doi:10.1038/s41591-023-02363-y
V 24突变的自然杀伤性T细胞(NKTs)具有一定的抗肿瘤特性,其能通过嵌合抗原受体(CARs)来增强;近日,一篇发表在国际杂志Nature Medicine上题为 Anti-GD2 CAR-NKT cells in relapsed or refractory neuroblastoma: updated phase 1 trial interim results 的研究报告中,来自贝勒医学院等机构的科学家们通过研究报告了首个人类1期临床试验的中期结果,该试验中,研究人员评估了一种遗传工程化的自然杀伤性T细胞(NKT)免疫疗法在治疗成神经细胞瘤(neuroblastoma)上的安全性、抗肿瘤活性和免疫特征,成神经细胞瘤是一种儿童肿瘤,其最常会发生在机体肾上腺部位,相关研究结果表明,这种疗法耐受性良好,且研究人员观察到了其能产生强大的抗肿瘤活性的早期证据。
在1期临床试验中 CAR-自然杀伤性T细胞疗法或有望表现出潜在的治疗结局。图片来源:Nature Medicine(2023). DOI:10.1038/s41591-023-02363-y
自然杀伤性T细胞能被修饰从而表达GD2特异性嵌合抗原受体(GD2 CAR),该受体能促使免疫细胞靶向作用成神经细胞瘤细胞表面的特殊分子以及白介素-15(IL-15),IL-15是一种能支持自然杀伤性T细胞生存的天然蛋白,在此前的研究中,研究人员报道了该试验中所招募的前三名儿童的中期研究结果。这篇研究中,研究人员描述了在对其它疗法耐受的12名处于4期复发性成神经细胞瘤患者机体中的研究结果,他们发现,该疗法在四个剂量的水平下对所有12名患者都是安全的,且关于剂量限制毒性上并没有相关报道,3名患者会对疗法表现出客观反映,包括一组完全的反应和两个部分反应。
另外两名患者也表现出了具有抗肿瘤活性的重要证据,比如清除骨髓受累并减少转移性肿瘤的负担,但目前尚未达到部分反应标准。研究者Andras Heczey说道,我们对在几名患者机体中所观察到的抗肿瘤活性结果感到鼓舞,尤其是因为这项临床试验还处于剂量递增阶段。此前研究结果表明,自然杀伤性T细胞在临床前模型中能定位到肿瘤位点,这一试验在人类机体中也呢狗验证安置额观察性结果,此外,研究人员还发现较高的抗肿瘤活性和所输注的CAR-自然杀伤性T细胞在体内增殖之间的关联。Leonid Metelitsa说道,我们并不能总是预测书诸侯自然杀伤性T细胞扩张的程度,在这项研究中,我们发现,在临床前工作中所识别出的输注自然杀伤性T细胞所表达的CD62L生物标志物或许能预测更高的自然杀伤性T细胞在体内扩张以及患者机体更高的抗肿瘤活性。
8.
doi:10.1016/j.omtn.2023.03.018
基因疗法已经被证明是一种真正的替代疗法,可以用来治疗几种没有适当治疗的疾病。然而,一些基因治疗策略的治疗效果并不是最好的,因为传递不充分或缺乏对转基因的控制。在基因治疗药物中,随着6种CAR-T药物的批准,嵌合抗原受体(CAR)-T细胞已成为治疗血液病最有前途的药物之一。然而,目前的CAR-T细胞经常出现严重的副作用(有时会导致致命的后果),而且它们对实体瘤的治疗并不有效。这两个限制都可以通过产生智能CAR-T细胞来部分解决,这些细胞可以在外部进行控制,以决定何时何地活跃,或者分泌有效的生物分子。

LOPIs2 LV是一种通用的工具,可以产生表达不同转基因的无反式激活子诱导细胞系。图片来源:
近日,来自格拉纳达大学的研究者们在Molecular Therapy Nucleic Acids杂志上发表了题为 Lentiviral vectors for inducible, transactivator-free advanced therapy medicinal products: Application to CAR-T cells 的文章,该研究描述了第一个无反式激活剂的、能够产生Dox诱导的ATMP的一体化系统。
通过外用诱导剂控制转基因表达被认为是提高基因治疗方法安全性和有效性的有效策略。一般来说,可诱导的ON系统需要一个嵌合的转录因子(反式激活因子),该因子被诱导剂激活,由于其毒性,这对临床翻译并不是最佳的。
研究者之前成功构建了第一个一体化、无反式激活剂、多西环素(Dox)反应(Lent-on-Plus或LOP)的慢病毒载体(LV),能够控制转基因在人类中的表达。在本研究中,研究者已经产生了新版本的LOP LV,并分析了它们在产生可诱导的高级治疗药物(ATMP)方面的适用性,特别是对原代人类T细胞的关注。
研究者已经证明,与所分析的所有其他细胞类型相反,为了控制人类原代T细胞中的转基因表达,必须在LOP LV的30个末端重复序列中插入Is2绝缘体。重要的是,由LOPIs2 LV产生的可诱导原代T细胞对超低剂量的Dox有反应,与未转导的T细胞相比,在表型或功能上没有变化。通过产生可诱导的CAR-T细胞来验证LOPIs2系统,该细胞在Dox存在的情况下选择性地杀伤CD19+细胞。
9.
doi:10.1126/sciadv.adf0108
前列腺癌经常会发生骨转移且是无法治愈的,近日,一篇发表在国际杂志Science Advances上题为 -Enriched CAR-T cell therapy for bone metastatic castrate-resistant prostate cancer 的研究报告中,来自H. Lee Moffitt癌症研究中心等机构的科学家们通过研究有望开发出治疗前列腺癌骨转移的患者。文章中,研究者表示,嵌合抗原受体T细胞疗法(CAR-T细胞疗法)或许在前列腺癌骨转移的小鼠模型中作为一种有效的抗肿瘤方法。
科学家开发出新型CAR-T细胞疗法治疗人类骨转移性前列腺癌。图片来源:Science Advances(2023). DOI:10.1126/sciadv.adf0108
研究者Conor Lynch博士说道,骨转移的前列腺癌是一种无法治愈的疾病,其会通过极度的骨痛来明显影响患者的生存,诸如唑来膦酸盐(zoledronate)等双磷酸盐(Bisphosphonates)能减缓患者的问题并减少其病理性的骨折,但对于患者的生存影响不大;因此,研究人员就迫切需要开发出新型的治疗手段。文章中,研究人员想通过研究调查利用CAR-T细胞疗法治疗骨转移性前列腺癌的可能性,以及这种疗法的治疗效果是否能通过与唑来膦酸盐的结合而被增强;CAR-T细胞疗法是一种相对交心的癌症疗法,这种形式的细胞免疫疗法2017年首次获批用于治疗特定类型的血液癌症,对于这种疗法而言,研究人员首先从患者体内分离到其T细胞,对其进行遗传工程化修饰来靶向作用肿瘤特异性的标志物,随后T细胞会在培养物中进行扩增并重新输注回患者体内,在患者体内其就能靶向摧毁患者机体的肿瘤细胞了。
研究者Abate-Daga指出,与传统的 / T细胞相比,我们对这些细胞的研究相对较少,但其近些年来却吸引了很多生物技术部门的关注和极大兴趣。研究人员创造了对肿瘤生物标志物前列腺干细胞抗原(PSCA,prostate stem cell antigen)具有特异性的CAR-T细胞,这类抗原在骨转移性前列腺癌中会高度表达;研究者认为,CAR-T细胞能杀灭细胞培养物中的前列腺癌细胞,并能刺激增强免疫细胞活性的化学信使分子的产生。
接下来研究人员开始对小鼠模型进行研究,结果发现,CAR-T细胞能明显减少肿瘤的尺寸并改善小鼠的生存且毒性非常有限;此外,利用唑来膦酸盐预先处理小鼠或能通过一种CAR非依赖性的机制来帮助激活CAR-T细胞,并能提高其识别和破坏肿瘤的能力;重要的是,除了能消除肿瘤外,这种疗法还能保护骨骼的健康。
10.
doi:10.1038/s41467-023-36160-5
瞬时表达肿瘤靶向受体的工程化T细胞或能作为一种有吸引力的工程化T细胞疗法形式,因为其并不会引入插入突变或长期不良副作用的风险,然而,患者往往需要进行多轮治疗,而这往往增加了患者的不适和治疗费用。近日,一篇发表在国际杂志Nature Communications上题为 G9a/GLP inhibition during ex vivo lymphocyte expansion increases in vivo cytotoxicity of engineered T cells against hepatocellular carcinoma 的研究报告中,来自新加坡A*STAR研究所等机构的科学家们通过研究发现,在细胞治疗生产过程中,抑制G9a和GLP两种蛋白的功能后,免疫细胞或许就能更加有效地抵御癌症了,相关研究结果或有望帮助开发让癌症患者获益的新型创新性疗法,并能让研究人员更加接近开发出针对实体瘤的更为有效的靶向性疗法。
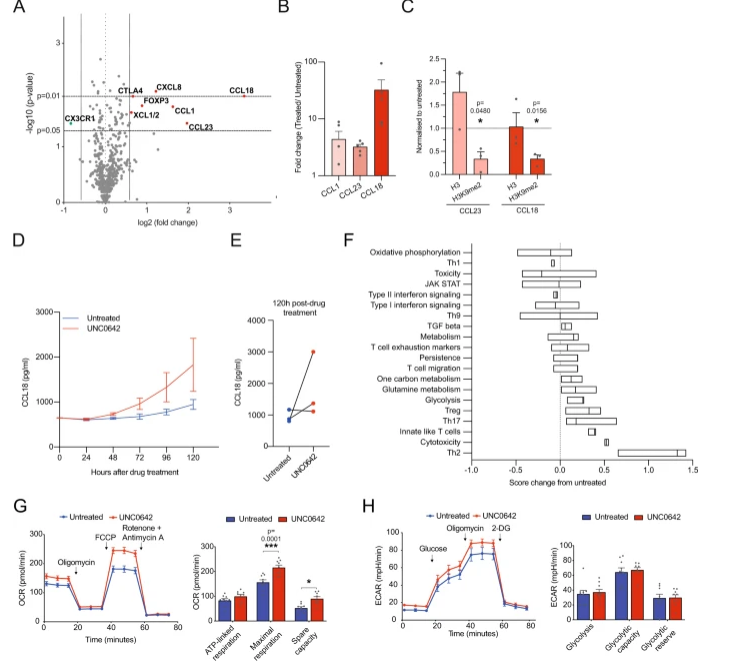
T细胞研究的新发现或能帮助改善对人类实体瘤的治疗。图片来源:Nature Communications(2023). DOI:10.1038/s41467-023-36160-5
实体瘤是全球范围为内癌症相关死亡的主要原因,诸如化疗、放疗和外科手术等传统疗法是可行的,但其在治疗人类实体瘤上的疗效并不同,尤其是对于癌症晚期患者;T细胞疗法就在治疗诸如血液癌症等液体肿瘤方面非常成功,但在治疗诸如、或脑癌方面却并未观察到同样的治疗效果。作为治疗的一部分,工程化的T细胞通常会被引入到患者的血液中,其与液体肿瘤一样处于相同的环境中,这或许就能促使其定位并更加容易地靶向作用液体肿瘤,然而,在实体瘤存在的情况下,工程化的T细胞就会面临物理和分子障碍,比如在体内通过致密组织结构来进行迁移,且遇到可能负面影响其功能的其它细胞或分子。
文章中,研究人员通过联合研究揭示了一种能改善T细胞疗效的新方法,T细胞是一种能识别并消除癌细胞的特殊免疫细胞。研究者Andrea Pavesi表示,我们对特殊的表观遗传学药物进行了全面的分析,这些药物能影响工程化T细胞在增加机体抗肿瘤活性上的疗效。我们使用了2D和新型3D分析方法来模拟T细胞所遭遇的物理环境,从而发现并靶向作用人类机体中的癌细胞。
在实验室所进行的细胞疗法的细胞扩增过程中,研究人员对免疫细胞施用了一种能靶向作用G9a和GLP蛋白的特殊药物,随后将这些药物洗掉,然后再将工程化的免疫细胞重新输注到患者体内并消除药物所产生的副作用,相关研究结果表明,这种药物或呢过帮助增加工程化免疫细胞的抗肿瘤功能,其会增加颗粒酶的产生,而颗粒酶是一种能帮助定位和消除目标肿瘤细胞的蛋白质。研究人员利用其对免疫细胞的分析能力以及杜克大学-新加坡国立大学的研究人员提供的患者样本进行研究,相关研究结果或能利用成熟的细胞系和患者机体所衍生的免疫细胞来进行验证,从而确认阻断G9a和GLP活性在改善T细胞疗法治疗效率方面的功效。( 100yiyao.com)
相关100医药网新闻:
CAR-T细胞疗法研究进展(第36期)
https://news.bioon.com/article/b9b6e6929370.html
CAR-T细胞疗法研究进展(第35期)
https://news.bioon.com/article/4b40e613612e.html
CAR-T细胞疗法研究进展(第34期)
https://news.bioon.com/article/4198e575451e.html
CAR-T细胞疗法研究进展(第33期)
https://news.bioon.com/article/c0b4e49733ba.html
CAR-T细胞疗法研究进展(第32期)
https://news.bioon.com/article/1cc9e41516ed.html
CAR-T细胞疗法研究进展(第31期)
https://news.bioon.com/article/18a5e37253a6.html
CAR-T细胞疗法研究进展(第30期)
https://news.bioon.com/article/9f42e3387698.html
CAR-T细胞疗法研究进展(第29期)
https://news.bioon.com/article/fa2de30910bc.html
CAR-T细胞疗法研究进展(第28期)
https://news.bioon.com/article/421ee25913ae.html
CAR-T细胞疗法研究进展(第27期)
https://news.bioon.com/article/2b8ce2333732.html
CAR-T细胞疗法研究进展(第26期)
https://news.bioon.com/article/6925e22593aa.html
CAR-T细胞疗法研究进展(第25期)
https://news.bioon.com/article/38c6e1997279.html
CAR-T细胞疗法研究进展(第24期)
https://news.bioon.com/article/1d0ce18970c8.html
CAR-T细胞疗法研究进展(第23期)
https://www.bioon.com/article/6790460.html
CAR-T细胞疗法研究进展(第22期)
https://news.bioon.com/article/6787633.html
CAR-T细胞疗法研究进展(第21期)
https://www.bioon.com/article/6786803.html
CAR-T细胞疗法研究进展(第20期)
https://news.bioon.com/article/3288e1261464.html
CAR-T细胞疗法研究进展(第19期)
https://www.bioon.com/article/6783616.html
CAR-T细胞疗法研究进展(第18期)
https://www.bioon.com/article/6781383.html
CAR-T细胞疗法研究进展(第17期)
https://news.bioon.com/article/6778905.html
CAR-T细胞疗法研究进展(第16期)
https://www.bioon.com/article/6759479.html
CAR-T细胞疗法研究进展(第15期)
https://news.bioon.com/article/6758088.html
CAR-T细胞疗法研究进展(第14期)
https://www.bioon.com/article/6756207.html
CAR-T细胞疗法研究进展(第13期)
https://news.bioon.com/article/6751734.html
CAR-T细胞疗法研究进展(第12期)
https://news.bioon.com/article/495b68093975.html
CAR-T细胞疗法研究进展(第11期)
https://www.bioon.com/article/6748552.html
CAR-T细胞疗法研究进展(第10期)
https://www.bioon.com/article/6747291.html
CAR-T细胞疗法研究进展(第9期)
https://www.bioon.com/article/6744554.html
CAR-T细胞疗法研究进展(第8期)
https://news.bioon.com/article/6741848.html
CAR-T细胞疗法研究进展(第7期)
https://www.bioon.com/article/6738997.html
CAR-T细胞疗法研究进展(第6期)
https://news.bioon.com/article/4e27668e7876.html
CAR-T细胞疗法研究进展(第5期)
https://news.bioon.com/article/6728191.html
CAR-T细胞疗法研究进展(第4期)
https://news.bioon.com/article/6722761.html
CAR-T细胞疗法研究进展(第3期)
https://www.bioon.com/article/6713293.html
CAR-T细胞疗法研究进展(第2期)
https://www.bioon.com/article/6709104.html
CAR-T细胞疗法研究进展(第1期)
https://news.bioon.com/article/6702848.html
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 超10亿美元!赛诺菲引进一款p38α/β抑制剂 (2024-05-17)
- 昼夜颠倒,慢性病风险飙升?JPR:科学家揭示夜班工作增加机体患糖尿病和肥胖症背后的分子机制 (2024-05-17)
- JAMA:剑指脂肪肝,阿司匹林再发力!哈佛证实,仅6个月,减少10%肝脏脂肪 (2024-05-17)
- 《细胞·代谢》:血管硬化,竟源于“贪吃”!科学家揭秘血管周围胶原蛋白沉积原因,减少谷氨酰胺和丝氨酸饮食摄入或可治疗肺动脉高压 (2024-05-17)
- 颠覆认知!Nature子刊:睡眠时大脑可能无法高效排毒,而是在… (2024-05-17)
- Nature子刊:复旦大学余宏杰团队在麻疹母传/疫苗诱导免疫应答机制领域取得重要进展 (2024-05-17)
- PNAS:科学家们揭示了CRL3在肝脏代谢调节中的关键作用 (2024-05-16)
- 超20亿美元!武田引进一款抗Aβ疫苗 (2024-05-16)
- Circulation (2024-05-16)
- Nat Commun (2024-05-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















