四省药监局结合发文,新医疗器械联盟来了! |
 |
医药网10月30日讯 重磅停顿,长三角医疗器械注册人轨制一体化构成。(文末附文件概况)
四省构成,新联盟构成
9月29日,据江苏省药品监视治理局新闻,上海、江苏、浙江、安徽四地药监局结合宣布《长江三角洲区域医疗器械注册人轨制试点任务施行计划》。
据悉,此次的年夜举动是依照国度药品监视治理局《关于扩展医疗器械注册人试点任务的告诉》的请求来停止,以长江三角洲区域医疗器械家当一体化。
由此可以看出,长三角医疗器械注册人轨制一体化构成。“医疗器械注册人轨制”这一医疗器械行业的立异性的变革,最早从上海试点,后扩展到天津、广东两地。
2019年8月,国度药监局相干告诉又明白,北京、天津、河北、辽宁、黑龙江、上海、江苏、浙江、安徽、福建、山东、广东等21个省、自治区、直辖市参与医疗器械注册人轨制试点。
怎样结合?有什么影响?
什么是医疗注册人轨制,阅历了如何的变更?
此前,在2014年10月起施行的《医疗器械临盆监视治理方法》中明白规则,拿到医疗器械注册证才干请求第二类、第三类医疗器械的临盆答应证,而获得临盆答应才干临盆、受托临盆响应医疗器械。也即把注册与临盆答应绑缚在一路,必需由一个主体来完成。
如今,医疗器械注册人轨制产生变革,许可企业、机构和人员独自请求医疗器械注册证,再以注册人的身份委托其他企业临盆响应的医疗器械。即注册和临盆答应可以不由一个主体来完成。
形式变更:
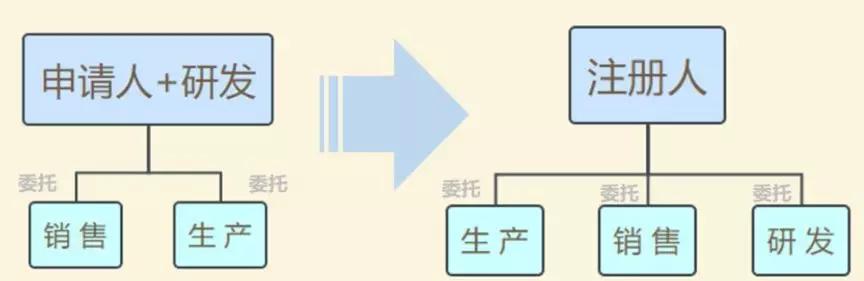
(图片起源:CFDA律例在线)
“注册人轨制完成了产物注册和临盆答应的解绑,更利于鼓舞立异、整合社会资本、放慢医疗器械产物上市”,上海市药监局医疗器械监管处处长林森勇以为。
多家企业初尝甜头
在详细落实上,经国务院同意,行业变局由上海开启。
2018年2月8日,上海远心医疗科技无限公司的单道心电记载仪取得由上海市药监部分发表的第二类医疗器械产物注册证,成为国际首个享用到医疗器械注册人轨制新政的产物。
持有注册证的远心医疗和受托临盆的微创电心理都从属于上海微创,其由此成为我国医疗器械注册人轨制试点的首个赢家。
上海微创医疗器械无限公司副总裁李勇说,从我们企业试点理论来看,新政年夜年夜浪费了研发本钱投入。以我们首个取得试点注册证的产物为例,浪费了1000多万元研发投入。
尝到甜头的上海微创,测验考试力度越来越年夜。截至今朝,该企业曾经有7家公司12个产物请求注册人,个中有2个产物已取得注册证。
据悉,除上海微创的2个产物外,上海还有4家企业6个产物在试点进程中获批。试点方式还呈现了扩展临盆场地、多点委托,注册工资科研型企业、医工互动,非联系关系主体跨区域委托、出口产物转国产化等。
美敦力、迈瑞接连呼应
医疗器械注册人轨制可以延长产物上市周期、进步效力的优势曾经浮现,并且从上海的理论也能印证,轨制变革曾经为行业带来改动,国际医械龙头企业也接连“启航”。
就美敦力来说,与上海微创分歧的是,美敦力的委托临盆方为捷普科技(上海)无限公司,这是一家专业的第三方代工企业。以其获批的手术动力零碎为例,委托后,该产物获批上市仅用了45天的工夫。
上海市药监局医疗器械注册处处长林峰就此表现,该产物原应作为出口产物注册,但在试点进程中是当地注册、当地制作,使得当地化转移成为能够。该产物上市也意味着未来我国会有更多先辈医疗器械不再经过出口,而是经过当地注册、临盆,完成疾速上市。
多方等待试点规模扩展
从今朝各地施行的成果来看,注册人轨制试点任务获得必定成效,但还存在必定成绩。
比方一些企业将注册人轨制复杂懂得为委托临盆,没无意识到注册人要对医疗器械全性命周期的质量治理承当主体义务;有些企业为享用试点时代的鼓舞政策(如优先审评等),锐意拆分出持证人或受托人;部门持有人和委托人之间发生常识产权胶葛等。
须要看到的是,因为今朝试点规模的局限性,医疗器械注册人轨制固然不时释放盈余,然则速度方面还需增强。
浙江省药监局有关担任人坦言,本钱的逐利性决议其会选择情况好、本钱低的地域停止临盆。上海的临盆本钱绝对较高,注册人完整可到周边省份去寻觅协作同伴。尤其是在“将长三角区域一体化成长上升为国度计谋”配景下,注册人试点应拓展到上海周边省份。
业内子士就此成绩谈到,在试点进程中,医疗器械注册人该当具有哪些才能或许前提,该当承当哪些责任;医疗器械注册人轨制施行会给监管带来哪些挑衅,这些挑衅若何破解等成绩,还需进一步评论辩论与研讨,须要在理论中不时摸索。
----------------------------------------
附件:
长江三角洲区域医疗器械注册人轨制试点任务施行计划
(试行)
为深化贯彻落实中共地方办公厅、国务院办公厅印发的《关于深化审评审批轨制变革鼓舞药品医疗器械立异的看法》(厅字〔2017〕42号),依照国度药品监视治理局《关于扩展医疗器械注册人试点任务的告诉》(国药监械注〔2019〕33号)的请求,推动长江三角洲区域(以下简称“长三角”)医疗器械家当高质量一体化成长,为全国片面施行医疗器械注册人轨制进一步积聚经历,在上海、广东、天津自贸区展开医疗器械注册人轨制试点任务的根底上,经上海市、江苏省、浙江省、安徽省药品监视治理局协商分歧,特制订长三角医疗器械注册人轨制试点任务施行计划。
一、试点目的
经过试点,摸索树立医疗器械委托临盆治理轨制,优化资本设置装备摆设,落实主体义务;摸索树立完美的注册人医疗器械质量治理系统,明白医疗器械注册人、受托人等主体之间的司法关系;摸索立异医疗器械监管方法,厘清跨区域监管义务,构成完美的跨区域协同监管机制;摸索释放医疗器械注册人轨制盈余,鼓舞医疗器械立异,推进长三角医疗器械家当高质量一体化成长,更好知足"日益增加的高品德安康办事需求。
二、试点内容
医疗器械注册请求人(以下简称“请求人”)请求并获得医疗器械注册证的,成为医疗器械注册人(以下简称“注册人”)。请求人可以委托具有响应临盆才能的企业临盆样品。注册人可以委托一家或多家契合前提的医疗器械临盆企业临盆已获证产物。受托临盆企业可提交注册人的医疗器械注册证请求临盆答应。
三、注册人前提和责任义务
(一)注册人前提
1.居处或临盆地址位于长三角内的企业、科研机构。
2.具有专职的律例事务、质量治理及上市后事务等任务相干的技巧与治理人员,其具有医疗器械监管律例和尺度相干常识和经历。
3.树立与产物相顺应的质量治理系统并坚持无效运转,有对证量治理系统自力停止评价、审核和监视的人员。
4.具有承当医疗器械质量平安义务的才能,确保研讨进程严谨标准,提交的研讨材料和临床实验数据真实、完好、可追溯。
5.具有优越信用,未被归入严重掉信名单或被相干部分施行信誉结合惩戒。
(二)注册人的责任义务
1.承当医疗器械设计开辟、临床实验、临盆制作、发卖配送、售后办事、产物召回、不良事情申报等环节中的响应司法义务。
2.该当对受托临盆企业的质量治理、临盆才能停止综合评价,并构成评价申报。契合请求的,与受托临盆企业签署委托合同和质量协定,明白单方委托临盆中技巧请求、质量包管、义务划分、放行请求等,明白临盆放行请求和产物上市放行方法。
3.该当将设计开辟的技巧请求、临盆工艺、原资料请求及阐明书和标签等技巧文件无效转移给受托临盆企业,确保委托临盆运动契合医疗器械临盆质量治理标准请求。
4.增强对受托临盆企业的监视治理,对受托临盆企业的质量治理才能停止评价,按期对受托临盆企业展开质量治理系统评价和审核,构成年度质量治理自查申报。
5.委托临盆产物的医疗器械阐明书、标签除契合有关规则外,还该当标明受托临盆企业的企业称号、居处、临盆地址、临盆答应证编号。委托临盆变革或终止时,该当对注册证所载明的相干信息停止变革。
6.发明受托临盆企业的临盆前提产生变更,不再契合医疗器械质量治理系统请求的,该当立刻请求受托临盆企业采用整改办法。能够影响医疗器械平安、无效的,该当立刻请求受托临盆企业停滞临盆运动,并向注册人地点地省级药品监视治理部分申报。
7.可以自行发卖其获得注册证的医疗器械,也可以委托具有相干天资的医疗器械运营企业发卖。自行发卖的注册人该当具有规则的医疗器械运营才能和前提;委托发卖的,该当签署委托合同,并严厉实行协定商定的责任。
8.委托贮存、运输医疗器械的,该当对受托方的质量包管才能和风险治理才能停止评价,与其签署委托协定,商定质量义务、操作规程等外容,并对受托方停止监视。
9.增强不良事情监测,依据风险品级树立医疗器械响应的追溯治理轨制,确保医疗器械产物可知足全程追溯的请求。
10.经过信息化手腕,对研发、临盆、流畅和不良事情监测情形停止全流程追溯、监控。
11.应与受托方签署常识产权维护协定,明白单方的义务和责任。
12.该当树立年度申报轨制,每年将医疗器械临盆发卖、上市后监测、风险治理等情形依照规则向地点区域的省级药品监视治理部分申报。
四、受托临盆企业前提和责任义务
(一)受托临盆企业前提
1.居处或临盆地址位于长三角区域内的企业。
2.具有与受托临盆医疗器械相顺应的质量治理系统和临盆才能,能按期展开外部审核和完成年度质量治理自查申报。
3.具有合营注册人做好设计开辟的技巧请求、临盆工艺、原资料请求及阐明书和标签等技巧文件的无效转移的前提和才能。
4.具有优越信用,未被归入严重掉信名单或被相干部分施行信誉结合惩戒。
(二)受托临盆企业责任义务
1.承当《医疗器械监视治理条例》等相干司法律例以及委托合同、质量协定规则的责任,并承当响应的司法义务。
2.依照医疗器械相干律例规则以及委托合同、质量协定商定的请求组织临盆,对注册人负响应质量义务。
3.该当与注册人签署常识产权维护协定,明白单方的义务和责任。
4.受托临盆企业该当契合《医疗器械临盆质量治理标准》及相干附录的请求,鼓舞企业经过YY/T0287/ISO13485《医疗器械质量治理系统用于律例的请求》认证。
5.当不再临盆医疗器械或不具有受托医疗器械临盆前提时,该当自动请求登记所持有的医疗器械临盆答应证或核减临盆规模。
6.临盆前提产生变更的,不再契合医疗器械质量治理系统请求的,该当立刻采用整改办法。能够影响医疗器械平安、无效的,该当立刻停滞临盆运动,向注册人申报的同时,申报受托临盆企业地点地省级药品监视治理部分。
7.发明上市后医疗器械产生严重质量变乱的,向注册人申报的同时,该当实时申报本企业地点地省级药品监视治理部分。
8.受托临盆企业不得再次转托。
五、其他主体的责任与义务
受请求人/注册人委托停止研发、临床实验、发卖配送的主体,须承当司法律例规则的义务和协定商定的义务。请求人/注册人该当经过全程的治理、保护和掌握运动实行主体义务。对为医疗器械研制、临盆、运营、应用等运动供给产物或许办事的其他相干单元,该当承受药品监视治理部分的延长反省。
六、委托临盆产物规模
本《计划》中委托临盆的医疗器械是指,依照医疗器械分类规矩被划分为第二类或第三类的医疗器械(含立异医疗器械和样品),不包括第一类医疗器械。属于原国度食物药品监视治理总局宣布的制止委托临盆医疗器械目次的产物,准绳上不列入试点规模。
注册人可以同时委托多家医疗器械临盆企业临盆产物。委托临盆医疗器械的产物技巧请求、临盆工艺、质量治理系统,必需与委托方的请求坚持分歧并契合相干律例请求。注册人多点委托临盆的,对其核发的医疗器械注册证该当载明一切委托临盆的临盆地址。
鼓舞团体公司经过注册人轨制试点进一步整合、优化资本设置装备摆设,落实医疗器械注册人主体义务。注册人因收买、重组、分立、股份让渡等缘由改动企业称号,但产物临盆地址、尺度、临盆工艺、工序等没有产生改动的,参照注册人称号产生变更情况请求挂号事项变革。
七、操持法式
(一)注册请求
契合《计划》请求的第二类医疗器械注册请求人向地点地省级药品监视治理部分提交注册请求材料;第三类医疗器械注册请求人向国度药品监视治理局提交注册请求材料。注册人地点地省级药品监视治理部分组织注册系统核对。经审查契合请求的,核发医疗器械注册证,医疗器械注册证中刊登的临盆地址如为受托临盆的,备注栏标注受托临盆企业称号。
(二)临盆答应
注册人委托临盆的,受注册人委托的具有响应临盆天资的受托临盆企业可提交注册人的医疗器械注册证向其地点地的省级药品监视治理部分请求受托临盆答应。受托临盆企业地点地省级药品监视治理部分会同注册人地点地省级药品监视治理部分展开现场核对。经单方审查分歧以为契合请求的,核产生产答应证或在医疗器械临盆产物挂号表中刊登受托临盆产物信息。
(三)临盆地址变革
注册人拟经过委托临盆方法变革注册证临盆地址的,或许受托临盆企业临盆地址产生变革的,受托临盆企业该当向其地点地省级药品监视治理部分请求临盆答应变革。注册人提交受托临盆企业变革后《医疗器械临盆答应证》和委托协定向其地点地省级药品监视治理部分操持注册证的临盆地址挂号事项变革。
当注册人变革受托临盆企业时,原受托临盆企业该当在受托临盆终止时向其地点地省级药品监视治理部分请求核减医疗器械临盆答应所附临盆产物挂号表中刊登的受托产物信息,新受托临盆企业请求受托临盆答应。
(四)受托立案
受托临盆企业该当向地点地省级药品监管部分立案,立案时该当提交委托合同、质量协定等材料。
八、监视治理
依照“成绩导向,防备风险,分级监管,义务了了”的准绳,各级药品监视治理部分该当增强注册人实行医疗器械质量治理、上市发卖与办事、医疗器械不良事情监测与评价、医疗器械召回等情况的监视治理,强化注册人医疗器械全性命周期治理义务和全链条的治理才能,催促受托临盆企业严厉治理、标准临盆。引入行业协会、第三方机构协同治理,积极推动监管方法的改变和完美。出力构建权责明晰、依法公平、通明高效、标准有序的事中过后监管系统。
(一)监管职责分工
在国度药品监视治理局和试点的省级国民当局引导下,试点省级药品监视治理部分担任医疗器械注册人轨制试点任务,以及跨区域监管的调和任务,研讨并构建医疗器械事中过后监管新的形式。
注册人地点地药品监视治理部分担任辖区内注册人的监视治理任务,受托临盆企业地点地药品监视治理部分担任辖区内受托临盆企业的监视治理任务。
请求第三类医疗器械注册由国度药品监视治理局依照相干规则停止审评审批,试点的省级药品监视治理部分积极做好响应合营和支撑任务。
(二)增强区域监管连接
一是树立信息共享机制,经过网上监管信息平台及时共享和推送信息,实在增强对注册人、受托临盆企业等主体的监视治理。二是树立谈判机制,互通监管信息,实时移送成绩线索,确保监管义务落到实处。三是树立协同监管机制。关于跨区域委托临盆的注册人,注册人地点地药品监视治理部分可会同受托临盆企业地点地药品监视治理部分,展开协同监管。关于产生严重平安事情、严重不良事情、严重质量变乱等质量平安信息的,实时停止传递,各地监管机构该当调和分歧,合力处理。四是树立反省成果互认机制,试点展开反省员同一集中学习实训,进步反省员专业素养,同一反省尺度,明白反省请求,依照分类分级请求实施综合监管。摸索跨区域抽调反省员展开跨区域反省,冲破跨区域反省妨碍,树立由注册人包管医疗器械质量系统为焦点的企业义务系统。树立和完美跨区域联动监管机制,确保监视反省顺遂停止,落实监管主体义务。
(三)增强事中过后监管
一是药品监视治理部分该当重点存眷和核对委托单方义务责任的实行情形。
二是药品监视治理部分该当对注册人及受托临盆联系关系方的质量治理系统运转的合规性、真实性、零碎性和无效性展开重点反省和评价。
三是药品监视治理部分该当对注册人的外部审核、治理评审、变革掌握、年度自查申报、不良事情监测情形以及治理者代表履本能机能力等情形停止重点核对。
四是药品监视治理部分该当对注册人在展开不良事情监测、顾客反应、产物平安风险信息搜集与评价,以及企业表里部审核时所发明成绩的预防改正办法落实情形停止重点反省。
五是药品监视治理部分该当按规则自动地下请求人/注册人医疗器械审批成果等相干信息,承受社会监视。
六是增强行业自律。经过完美年度质量治理系统运转自查请求,引诱注册人和受托临盆企业基于诚信自律照实展开自查自纠,并提交年度质量治理系统自查申报。依照医疗器械注册人质量治理系统施行指南、医疗器械注册请求人委托临盆质量协定撰写指南等相干质量治理请求,鼓舞行业协会等机构宣布自查自律信息,充沛发扬行业质量信誉自律和根底治理感化。
七是引入第三方机构、行业协会介入评价和协同治理,完成社会共治。药品监视治理部分该当可委托第三方机构、行业协会展开对注册人和受托临盆企业的质量治理系统无效运转情形停止评价。
九、保证办法
(一)增强组织引导
由上海市、江苏省、浙江省、安徽省药品监视治理局构成由分担引导担负组长的试点任务组,树立试点任务沟通谈判轨制,研讨拟定试点任务施行计划和《长江三角洲区域医疗器械注册人轨制跨区域监管暂行方法》等相干治理轨制,增强试点各方的信息互通和任务调和,实时总结经历,妥当剖析处理碰到的实践成绩并构成处理建议,实时上报国度药品监视治理局。
(二)施行鼓舞政策
对归入试点的请求人加年夜技巧指点和办事力度。鼓舞注册人购置贸易义务险。树立同一信息平台,慢慢完成审评尺度同一、反省尺度趋同、审批成果互认、监管结论共享,为片面推动长三角医疗器械高质量一体化成长打好根底。
十、其他
(一)归入国度扩展试点规模的省、直辖市的企业,介入长三角试点的,可参照本计划履行。
(二)省际间的其他试点事项,可协商处理。
医药网新闻
- 相关报道
-
- 121种药通过初审 国度医保局将初次订定商保立异药目次 (2025-08-14)
- 市场监管总局:2025年上半年医疗告白守法案件罚没金额1278万元 (2025-08-14)
- 国度医保局地下宣布第五批智能监管“两库”规定和常识点 (2025-08-14)
- 534个药品通过2025年国度医保药品目次模式审查 (2025-08-13)
- 中国立异药:从根底研讨莅临床利用 不时加强的环球竞争力 (2025-08-13)
- 云南辅助生殖归入医保报销已惠及近2万家庭 (2025-08-12)
- 首项医疗保证畛域国度尺度宣布 来岁1月1日起施行 (2025-08-11)
- 西医药在基孔肯雅热的防控方面有何劣势?专家解答 (2025-08-06)
- 湖南颁布下层医疗卫生气希望构五类疾病药品推销清单 (2025-08-06)
- 湖南展开2025年度医疗机构制剂目次调整任务 (2025-08-06)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















