你好,罗氏!梯瓦在美国推出首个美罗华生物仿造药Truxima,罗氏三年夜王牌生物制剂片面失守! |
 |

2019年11月08日讯 /BIOON/ --梯瓦制药(Teva)与协作同伴韩国生物制药公司Celltrion近日结合宣告,在美国市场推出Truxima(rituximab-abbs,利妥昔单抗),该药是罗氏王牌生物制剂Rituxan(美罗华,通用名:rituximab,利妥昔单抗)的,具有完好的学标签。
Truxima今朝实用于非霍奇金淋巴瘤(NHL)和慢性淋巴细胞(CLL)成人患者的医治,详细为:
——NHL医治方面:(1)作为一种单药疗法,医治复发性或难治性、初级别或滤泡性、CD20阳性B细胞NHL患者;(2)结合一线化疗用于既往未承受医治的滤泡性、CD20阳性B细胞NHL患者,以及作为单药保持疗法用于承受一种利妥昔单抗产物与化疗结合医治完成完整或部门缓解的滤泡性、CD20阳性B细胞NHL患者;(3)作为一种单药疗法,用于承受一线CVP化疗(环磷酰胺+长春新碱+泼尼松)后病情未停顿的初级别、CD20阳性B细胞NHL患者;(4)结合CHOP(环磷酰胺+阿霉素+长春新碱+强的松)或其他蒽环类化疗计划,医治既往未承受医治的漫溢性年夜B细胞、CD20阳性NHL患者。
——CLL医治方面:结合氟达拉滨和环磷酰胺(FC),医治既往未承受医治(初治)和既往已承受医治(经治)CD20阳性CLL成人患者。
在美国,Truxima是获FDA同意的首个利妥昔单抗生物仿造药,同时也是获同意医治NHL的首个。Truxima于2018年11月底取得FDA同意,此次同意基于一个片面的数据包,包含根底性的和普遍的剖析表征、非临床数据、临床药理学、免疫原性、临床疗效和平安性数据。2019年5月,同意Truxima契合参考药物Rituxan医治NHL和CLL的一切学顺应症。
依据与罗氏旗下基因泰克杀青的专利息争,梯瓦和Celltrion手中今朝持有一份等候向美国提交的关于医治类(RA)、肉芽肿性多管炎(GPA)和显微镜下多管炎(MPA)的请求,以及来自基因泰克关于在2020年第二季度扩大Truxima标签至包含上述顺应症的一份答应。
订价方面,Truxima的零售推销本钱(WAC)较罗氏品牌名Rituxan低10%。Truxima 100mg瓶装WAC价钱为845.55美元,500mg瓶装WAC价钱为4227.75美元。不外,患者和供给商的实践付出本钱估计将低于WAC。
依据生物仿造药数据库,截至今朝,共有24个取得了同意,个中9个针对罗氏三年夜王牌生物制剂:安维汀(2个)、赫赛汀(5个)、美罗华(2个)。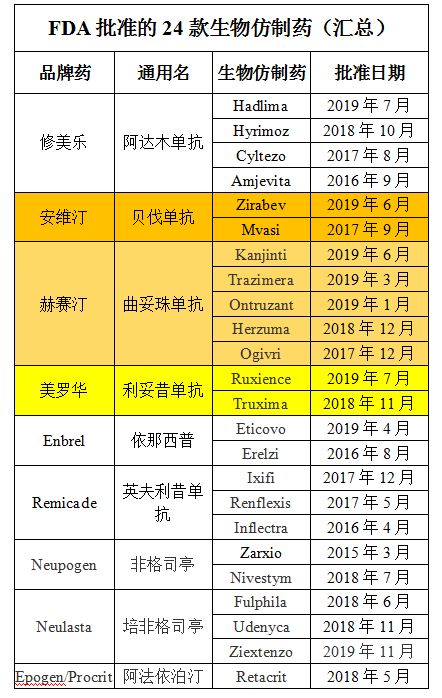
本年7月,安进和艾尔建宣告在美国市场推出Mvasi和Kanjinti,这2款药物辨别是登录美国市场的首个安维汀生物仿造药和首个赫赛汀生物仿造药,价钱均比罗氏品牌药低15%。梯瓦/Celltrion美罗华Truxima的上市,也标记着罗氏三年夜王牌生物制剂在美国市场片面失守。
依据GEN本年4月宣布的数据,安维汀、赫赛汀、美罗华在2018年的全球发卖额辨别为68.49亿、69.82亿、67.52亿瑞士法郎,在美国市场的算计发卖额为101.4亿美元。(100医药网100yiyao.com)
原文出处:
医药网新闻
- 相关报道
-
- 2025年7月Science期刊精华 (2025-07-31)
- 事关产假、托育服务、住房支持等 育儿支持政策步伐一览 (2025-07-31)
- 育儿补助哪些人可以领?什么时分领?多部分回应 (2025-07-31)
- 国度医保局地下宣布第三批智能监管“两库”规定和常识点 (2025-07-31)
- 我国国民西医药安康文明素养程度达26.85% (2025-07-31)
- Nature Genetics:拨开百年迷雾!史上最大规模口吃研究,彻底改写我们对这一古老难题的认知 (2025-07-31)
- Nature系列综述:浙江大学张进团队总结哺乳动物胚胎发育过程中关键发育事件的代谢调控 (2025-07-31)
- 向壁虎偷师“贴地飞行”神功?Adv. Mater.: 仿壁虎脚的软树枝颗粒,让膀胱癌药物告别“短命”,显著抑制肿瘤生长并调动免疫 (2025-07-31)
- Environ Sci Technol:铀的同位素组成或可用于无创测量肾脏中铀的积累 (2025-07-31)
- Immunity:血液中的蛋白质可能有助于预测疟疾的严重程度 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















