CAR-T细胞疗法研究进展(第50期) |
 |
(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞疗法。该疗法是一种出现了很多年但近几年才被改良,并使用到临床中的新型细胞疗法。在急性和非霍奇金的治疗上有着显著的疗效,被认为是最有前景的方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点!
1.
DOI:10.1038/s41586-025-09087-8
在癌症治疗的前沿领域,免疫疗法正逐渐成为攻克癌症的新希望。近年来,CAR-T细胞疗法在血液肿瘤治疗中取得了显著成效,但其在实体瘤治疗中的应用仍面临诸多挑战。与此同时,自然杀伤细胞(NK细胞)作为一种具有强大抗肿瘤活性的免疫细胞,逐渐受到科研人员的关注。
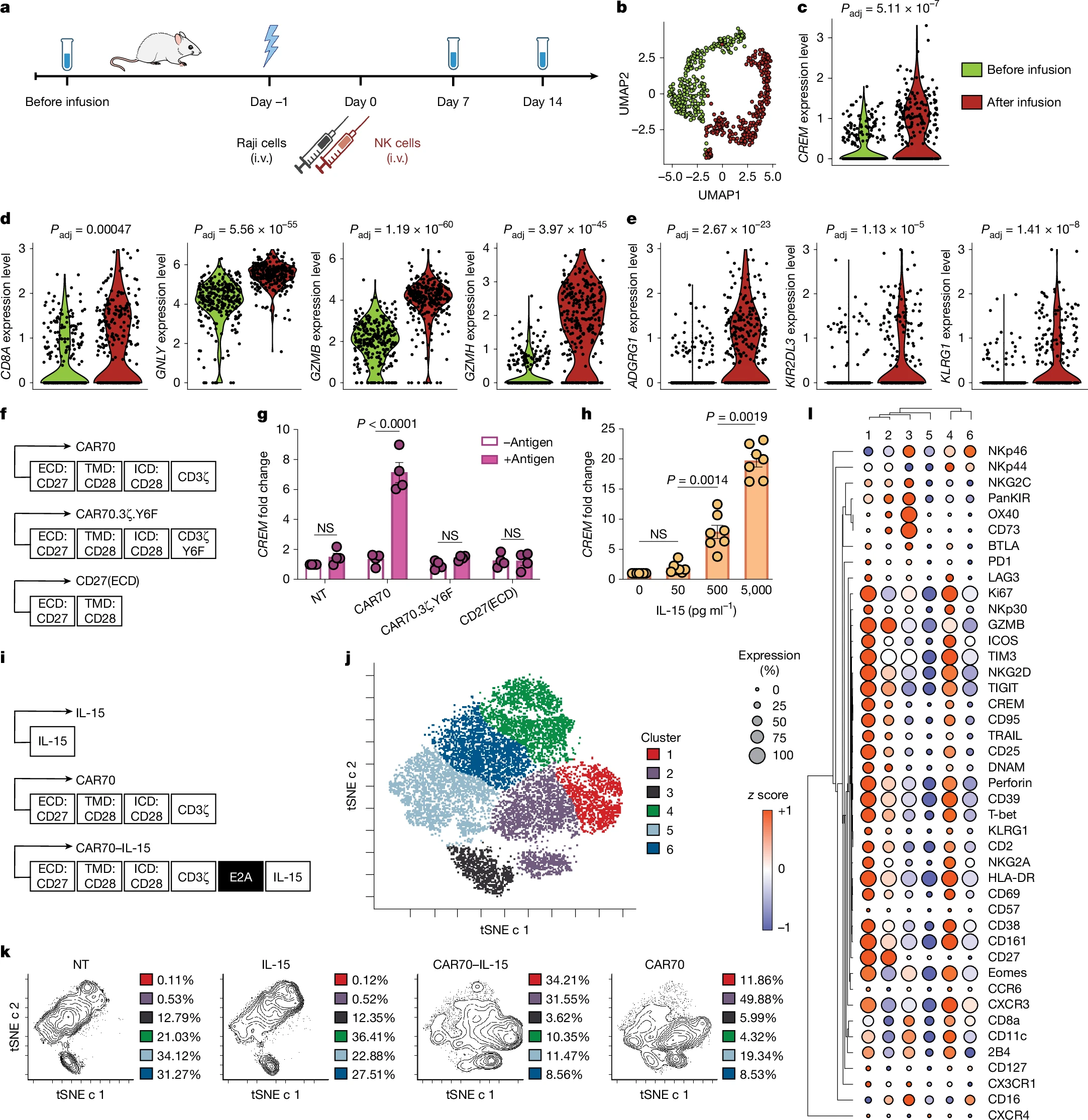
近日,一篇发表在国际杂志Nature上题为 CREM is a regulatory checkpoint of CAR and IL-15 signalling in NK cells 的研究报告中,来自德克萨斯大学MD安德森癌症研究中心等机构的科学家们通过研究揭示了NK细胞中的一个关键调控因子 CREM,为CAR-NK细胞疗法的发展带来了新的曙光。
尽管CAR-NK细胞疗法在临床前研究中展现出巨大潜力,但目前对于其功能调控的具体分子机制仍知之甚少。这项研究旨在深入探索CAR-NK细胞的分子调控机制,从而提高其抗肿瘤效果。
在本研究中,研究人员主要以人类脐带血来源的NK细胞为研究对象,这些NK细胞经过基因工程改造能表达针对特定肿瘤抗原的CAR(嵌合抗原受体)。研究还涉及多种人类系,如Raji(伯基特淋巴瘤)、SKOV3()和UMRC3()等,用于评估CAR-NK细胞的抗肿瘤活性。实验中,研究人员采用了包括单细胞RNA测序(scRNA-seq)、流式细胞术、质谱流式细胞术(CyTOF)、染色质免疫沉淀测序(ChIP-seq)和基因编辑技术(CRISPR-Cas9)等多种前沿技术,从基因表达、蛋白质水平和表观遗传学等多个层面深入分析CREM在NK细胞中的作用。
2.患者
原文标题:
在一项新的1期临床研究中,来自德克萨斯大学 MD 安德森癌症中心的研究人员称,一种名为 AIC100 的新型嵌合抗原受体 (CAR) T 细胞疗法以 ICAM-1 蛋白为靶点,在两种晚期甲状腺癌患者中显示出令人鼓舞的反应和可接受的安全性。
德克萨斯大学 MD 安德森癌症中心移植与细胞疗法副教授Samer Srour博士在美国癌症研究协会(AACR)2025年年会上首次公布了这项I期临床试验的结果。
甲状腺未分化癌(anaplastic thyroid cancer, ATC)和复发/难治性分化不良甲状腺癌(poorly differentiated thyroid cancer, PDTC)的治疗方案有限且预后不佳,而CAR-T细胞疗法在这两种甲状腺癌的早期治疗中取得了有希望的结果,这表明CAR-T细胞疗法在为实体瘤患者带来益处方面取得了进展。在接受剂量水平2或3治疗的9名患者中,22%的患者观察到肿瘤明显缩小,56%的患者病情得到控制。
Srour说, 在两个剂量组别中观察到的反应令人鼓舞,证明了AIC100治疗这些侵袭性极强的甲状腺癌的潜力。这种癌症是最致命、侵袭性最强的癌症之一,由于目前的治疗方案有限,大多数患者的预后都很糟糕,只有六个月或更短的时间。
AIC100是第三代CAR-T细胞疗法,通过与肿瘤细胞表面上的ICAM-1结合来消灭它们。这种CAR产品共同表达一种叫做体生长抑素受体2(somatostatin receptor 2)的蛋白质,临床医生可以通过专门的正电子发射断层扫描(PET)来监测治疗效果。
3.
DOI: 10.1056/NEJMoa2408771
在一项针对B患者的1期临床研究中,一种下一代 装甲 CAR-T细胞疗法取得了令人鼓舞的结果,这些患者的B细胞淋巴瘤在多轮其他癌症治疗(包括市售的CAR-T细胞疗法)后仍无法治愈。这种新疗法使81%的患者癌症症状减轻,52%的患者病情完全缓解,其中一些最早接受治疗的患者病情得到了两年或更长时间的持久缓解。来自宾夕法尼亚大学佩雷尔曼医学院的研究人员将这项研究发表在NEJM杂志上。

CAR-T细胞疗法是一种个性化的癌症免疫疗法,由宾夕法尼亚大学医学博士Carl June和他的团队首次成功开发,它彻底改变了许多血癌的治疗方法,但在接受现有CAR-T细胞疗法的淋巴瘤患者中,有50%以上的患者不能获得长期缓解。
在美国食品药品局()批准的七种 CAR-T 细胞疗法产品中,有四种用于治疗各种类型的 B 细胞淋巴瘤。对于那些接受 CAR-T 细胞疗法后癌症复发或产生抵抗性的患者来说,预后很差,几乎没有其他选择。以前的研究表明,用现有的 CAR-T 细胞疗法重新治疗这些患者的效果并不好。
宾夕法尼亚大学医学院艾布拉姆森癌症中心血液肿瘤学副教授Jakub Svoboda医学博士说, 我很高兴宾夕法尼亚大学创造的这种新一代 CAR-T 细胞疗法对那些已经尝试过所有治疗淋巴瘤方法的患者非常有效。我们还欣喜地看到,这种新型产品的毒性与我们已经看到的商用 CAR 并无不同。
除了CAR-T细胞疗法的已知副作用(包括细胞因子释放综合征和神经毒性)外,IL18的添加并没有导致任何新的或意想不到的安全问题,这些副作用都得到了成功控制。研究人员还发现,患者之前接受的CAR-T细胞疗法可能会影响huCART19-IL18的疗效。
4.
DOI: 10.1182/blood.2024026758
霍奇金淋巴瘤和其他CD30+淋巴瘤给医学界带来了巨大挑战,尤其是对于难治或复发病例,传统疗法迄今为止疗效有限。
在一项新的1期临床研究中,来自圣保罗研究所的研究人员与圣保罗医院和何塞普-卡雷拉斯白血病研究所合作开发了一种靶向 CD30 蛋白质(HSP-CAR30)的创新性CAR-T 细胞疗法,该疗法对难治性 CD30+淋巴瘤患者有很好的疗效。具体而言就是,这种新型 CAR-T30 疗法能促进记忆 T 细胞的扩增,从而产生持久的反应,改善患者的临床疗效。相关研究结果发表在Blood杂志上。
最近,CAR-T 细胞疗法已成为治疗血液的一种有前途的替代疗法,在 B 细胞白血病和淋巴瘤方面取得了非常积极的成果。然而,由于经过基因修饰的T细胞缺乏持久性,且患者复发率高,CAR-T细胞疗法在 CD30+ 淋巴瘤中的应用受到了限制。此外,这方面的临床试验数量极少,也阻碍了新解决方案的开发。
得益于基因工程和生物技术的进步,研究人员克服了这些挑战,开发出了 HSP-CAR30,这是 CAR-T细胞疗法的优化版本,采用了新的策略来提高治疗性T细胞的功能和持久性。这一突破是抗击此类癌症的一个里程碑,为以前几乎没有治疗选择的患者带来了新的可能性。
这项1期临床试验涉及 10 名复发或难治性典型霍奇金淋巴瘤或 CD30+ T 细胞淋巴瘤患者,取得了非常积极的结果。
圣保罗医院血液科主任Javier Briones博士说, 最引人注目的是 100%的总体反应率,这在接受过多线治疗的患者中极为罕见。此外,50% 的患者获得了完全缓解,这意味着在成像研究和临床分析中无法检测到疾病。
5.
DOI: 10.1038/s43018-025-00982-7
随着人类年龄增长,其免疫系统效率逐渐下降,这对依赖免疫细胞调控的癌症疗法构成挑战。在一项发表于Nature Cancer杂志上的新研究中,来自瑞士洛桑大学、洛桑大学医院、日内瓦大学医院和洛桑联邦理工学院的研究团队证明,这种年龄相关的免疫衰退对CAR-T细胞疗法 当前最先进的癌症免疫治疗形式之一,具有可量化的影响。
CAR-T疗法通过对患者T细胞进行基因改造使其识别并摧毁。但是这项新研究发现,老年小鼠来源的CAR-T细胞存在线粒体功能受损、 干性(stemness) 降低和抗肿瘤活性减弱。造成这种现象的罪魁祸首是烟酰胺腺嘌呤二核苷酸(NAD)水平下降 NAD对细胞能量代谢和线粒体功能至关重要。
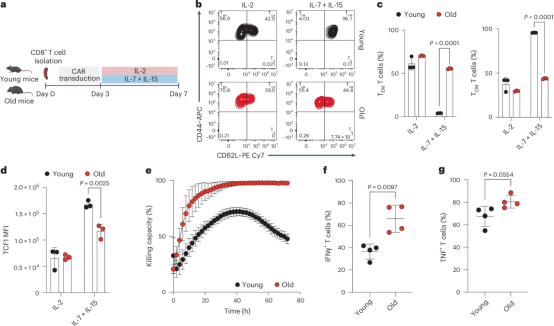
论文第一作者Helen Carrasco Hope博士说道, 老年个体的CAR-T细胞存在代谢缺陷,疗效显著降低。令人兴奋的是,我们通过恢复NAD水平使这些衰老的CAR-T细胞重获新生 在临床前模型中重新激活其抗肿瘤功能。
她补充道, 这些研究结果强化了学界对 衰老从根本上重塑免疫细胞功能与代谢 的认知,强调了在临床前研究中模拟年龄因素的紧迫性,以便使CAR-T细胞疗法开发更贴近真实癌症人群 其中大部分是老年患者。
6. Rheumatol:首次发现CD19 CAR-T细胞治疗自身免疫性疾病时出现局部免疫效应细胞相关毒性综合征
DOI: 10.1016/S2665-9913(25)00091-8
在一项新的研究中,来自埃尔朗根-纽伦堡大学的研究人员发现了一种以前未记录的与靶向CD19的CAR-T细胞治疗自身免疫性疾病相关的器官特异性毒性。这种称为局部免疫效应细胞相关毒性综合征(local immune effector cell-associated toxicity syndrome, LICATS)的现象影响了77%的患者,并且没有持久的并发症。相关研究结果发表在Lancet Rheumatology杂志上。
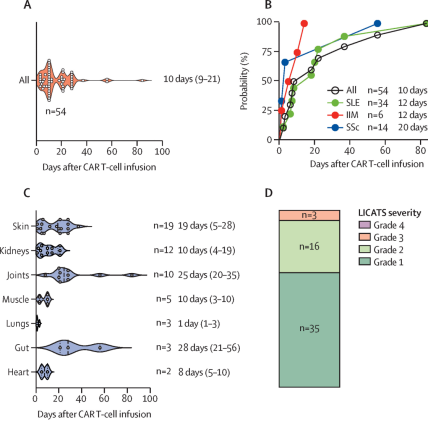
在这项研究中,研究人员通过观察性分析记录了CD19 CAR-T细胞输注后的器官定向反应。2021年3月至2024年10月期间,共有39名成人和青少年在埃尔朗根和杜塞尔多夫中心接受了第二代CD19 CAR产品MB-CART 19.1或KYV-101治疗,并完成至少30天随访。
临床人员追踪局部症状、实验室指标变化、影像学和活检结果,将事件按1级(自行消退)至4级(需重症监护)分级,并将发病分为早期、中期、晚期。研究人员排除了系统性细胞因子释放综合征(CRS),需要自发消退或短暂使用糖皮质激素来区分LICATS和疾病发作。
共在30名患者中发现54起LICATS事件,最常见表现为皮肤疹(35%)和肾(22%)。中位发作时间为输注后10天,持续中位时间11天。所有事件均发生在B细胞发育不全期间,且仅发生在每名患者自身免疫性疾病先前涉及的器官中。
约65%的发作未经治疗即消退,30%对短期糖皮质激素递减方案有效,仅3起事件需要再次住院。3起被归类为3级的事件导致住院时间延长。无患者需要重症监护,所有LICATS事件均消退,且没有持久的并发症。
7.
DOI: 10.1038/s43018-025-00968-5
在一项新的研究中,来自佐治亚理工学院的研究人员创造出了一种一举两得的方法,它能标记肿瘤细胞,使它们能被患者免疫系统中特别增强的T细胞识别并消灭。这种方法通过教导免疫系统发现它通常会错过的癌症,有朝一日可能会成为治疗某些最难治疗的癌症(如、和)的通用策略。他们的方法在实验室测试中对这些癌症有效,而且不会损害健康组织。重要的是,它还能阻止癌症复发。
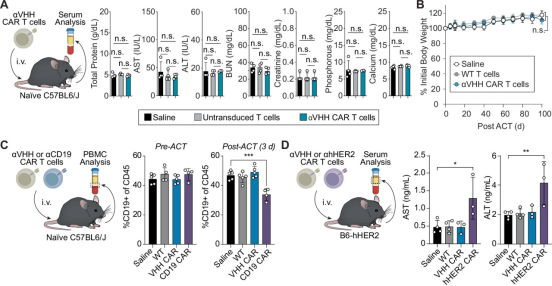
在这项新的研究中,佐治亚理工学院生物医学工程系副教授Gabe Kwong及其团队发现,他们可以利用基于脂质纳米颗粒的mRNA递送技术表达称为骆驼单域抗体(camelid single-domain antibody)VHH的合成抗原来标记肿瘤。然后,他们利用 CAR-T 细胞疗法训练机体的免疫系统寻找这种合成抗原,并消灭被标记的肿瘤细胞。
Kwong说, 肿瘤细胞很狡猾。大多数时候,免疫细胞基本上看不到它们,因为它们来自我们自身的组织。通常情况下,如果你要设计靶向癌症的 T 细胞,你需要找出每种不同癌症的特征,才能设计出靶向该癌症的 T 细胞。就这项研究而言,我们设计的 CAR-T 细胞能够识别这种合成抗原,这就成为了一个通用平台。
8.
DOI: 10.1158/0008-5472.CAN-24-1643
目前,半数非霍奇金淋巴瘤和急性患者对CAR-T细胞的治疗反应不佳。这种疗法包括采集患者自身的防御细胞(T细胞),在实验室中对其进行基因改造,使其能够摧毁肿瘤细胞,然后将其重新输注到相同患者的体内。这些难治性病例在接受常规免疫疗法后通常会复发。为了克服这一问题,巴西研究人员开发出了一种更强大的 CAR-T 细胞。相关研究结果发表在Cancer Research杂志上。
论文第一作者Maria Let cia Rodrigues Carvalho说, CAR-T细胞免疫疗法具有革命性意义,近年来挽救了许多人的生命。然而,仍有相当一部分患者对这种疗法没有反应。我们在CAR-T细胞上测试了一系列药物,其中一种药物抑制了使得这些细胞对这两种类型的血液肿瘤无效的表观遗传学改变(与基因表达模式有关),从而显示出希望。
正如这些作者解释的那样,非霍奇金淋巴瘤主要影响中年人,而淋巴细胞白血病患者主要是儿童。这些实验是在肿瘤细胞(体外)和小鼠(体内)上进行的,是未来开展人体临床试验的第一步。
在 CAR-T 细胞上测试的这些药物中,最有潜力的是一种名为 PRC2 的蛋白复合物抑制剂。在健康人体内,这些蛋白是诱导能阻止T细胞行动从而使它们不会攻击健康细胞的基因表达所必需的。
论文通讯作者Tiago da Silva Medina解释说, 然而,就癌症而言,重要的是没有这样的抑制因子来彻底消除肿瘤。虽然CAR-T细胞免疫疗法的基础正是去除这些抑制因子,但仍有一些抑制因子存在。我们所做的就是去除那些阻碍对非霍奇金淋巴瘤和急性淋巴细胞白血病产生更好反应的抑制因子。
9.
DOI: 10.1016/j.cell.2025.03.041
在癌症免疫疗法领域,CAR-T细胞疗法无疑是颗璀璨明珠。它通过基因修饰患者T细胞,使其表达能特异识别癌细胞的嵌合抗原受体(CAR),从而精准摧毁癌细胞。这项技术已成功应用于多种血液癌症治疗,包括急性淋巴细胞白血病、和特定淋巴瘤类型,并在实体瘤临床试验中展现出巨大潜力。
然而,随着CAR-T细胞疗法广泛应用,一个令人担忧的问题逐渐浮现:患者接受治疗后常报告出现 脑雾 现象,表现为记忆力减退和注意力难以集中。近期,斯坦福大学医学院领导的一项新研究在《Cell》杂志上发表,揭示了CAR-T细胞疗法可能导致的认知障碍问题。
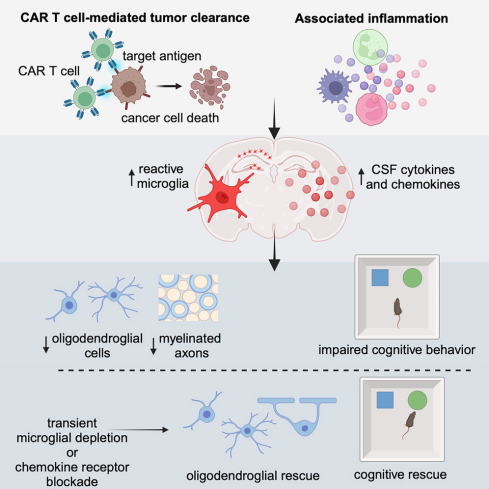
自2017年CAR-T细胞疗法获批用于急性淋巴细胞白血病治疗以来,其在癌症治疗领域的应用不断拓展。但尽管患者报告了认知功能下降现象,相关研究却相对滞后。研究团队负责人、斯坦福大学医学院儿科神经肿瘤学教授Michelle Monje博士强调: 我们需要全面了解CAR-T细胞疗法的长期影响,包括这种新发现的免疫疗法相关认知障碍综合征(IRCI),以便开发相应治疗方法。
研究团队在小鼠模型上展开广泛实验,测试CAR-T细胞疗法对认知功能的影响。他们构建了多种小鼠模型,包括弥漫性脑桥胶质瘤(DIPG)、急性淋巴细胞白血病(ALL)和模型,以评估CAR-T细胞疗法对系统(CNS)和非CNS癌症的认知影响。通过新型物体识别测试(NORT)和自发交替T迷宫测试(T Maze),研究人员发现,无论癌症是否起源于大脑、扩散到大脑还是完全位于大脑外,接受CAR-T细胞疗法的小鼠均表现出轻度认知障碍,表现为对新物体的反应迟钝和在迷宫中导航能力下降。
研究进一步揭示了认知障碍的潜在机制。实验结果显示,CAR-T细胞疗法后,小胶质细胞(大脑中的免疫细胞)被激活,释放炎症分子(如细胞因子和趋化因子),这些分子对少突胶质细胞(负责生成髓鞘的脑细胞)具有毒性。髓鞘损伤导致神经信号传递效率下降,从而引发认知障碍。研究人员通过流式细胞术、免疫组织化学和电子显微镜技术,分析了小胶质细胞的活性、少突胶质细胞前体细胞(OPCs)和成熟少突胶质细胞的数量变化,以及髓鞘超微结构的改变。他们还检测了脑脊液(CSF)中细胞因子和趋化因子水平,以评估CAR-T细胞疗法后的神经炎症反应。
10.
doi:10.1038/s41375-025-02573-y
在癌症治疗的战场上,CAR-T细胞疗法如同一位英勇的战士,为那些曾经被认为无药可救的患者带来了新的希望,这种创新的免疫疗法能通过改造患者自身的T细胞使其能精准识别并攻击癌细胞,而且已经在多种血液和淋巴系统癌症的治疗中取得了显著成效。而近日瑞典的科学家们通过一项开创性的研究再次证明了CAR-T细胞疗法在治疗效果和减少副作用方面的巨大潜力。
如今CAR-T细胞疗法在治疗某些血液和淋巴系统癌症方面取得了突破性进展,尤其是在那些传统治疗方法效果不佳的患者身上。瑞典的乌普萨拉大学医院是欧洲首个开展CAR-T细胞疗法临床试验的机构,自2019年以来,瑞典已经有多个治疗中心开始使用这种疗法。
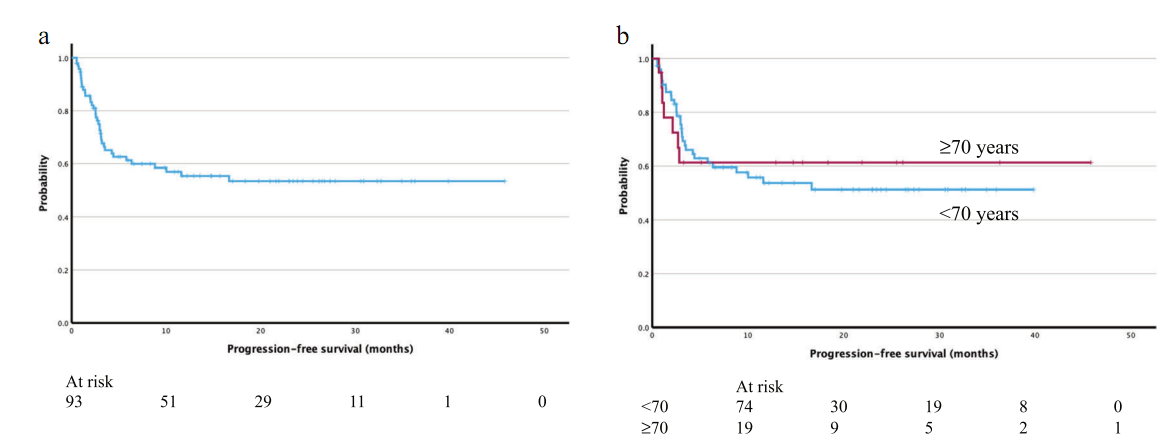
这篇发表在Leukemia杂志上题为 Implementation of standard of care CAR-T-cell treatment for patients with aggressive B-cell lymphoma and acute lymphoblastic leukemia in Sweden 的研究报告中,来自瑞典Skane大学等机构的科学家们汇总了瑞典患者接受CAR-T细胞疗法的治疗结果。
这项研究涵盖了93名患有侵袭性B细胞淋巴瘤(ABCL)的成年患者,其在2019年至2024年间接受了治疗。研究结果显示,66%的患者在接受治疗后30天内实现了完全缓解,即癌症完全消失;在接受治疗一年后,53%的患者没有复发。这一结果不仅令人鼓舞,而且在国际上也具有显著的优势。这项研究的一个特别引人注目的发现是,老年患者(70岁以上)的治疗效果并不比年轻患者差,这在以往的研究中是很少见的,因为老年患者通常被认为在治疗癌症时面临更多的风险和挑战。此外研究人员还发现,接受更高剂量免疫效应细胞相关神经毒性综合征(ICANS)治疗的患者,其无进展生存期(PFS)有所改善,这就表明,ICANS的严重程度可能与治疗效果有关,这一发现值得进一步研究。
11.
DOI: 10.1038/s43018-025-00934-1
抗癌疗法的一个主要目标是在不影响周围正常细胞的情况下杀死肿瘤细胞。因此,许多药物都是针对肿瘤特异性抗原设计的,这些抗原是仅由癌细胞表达的分子。然而,在包括急性髓性白血病(AML)在内的某些癌症类型中,很难确定这类特异性抗原。
AML患者通常采用异基因移植(allo-HCT)治疗,即接受捐赠者的造血干细胞移植。不幸的是,尽管allo-HCT取得了进步,但许多AML患者仍会复发。
在一项新的研究中,大阪大学领导的一个多机构研究小组介绍了如何将一种名为HLA-DRB1的分子用作基于嵌合抗原受体(CAR)疗法治疗AML的靶点。相关研究结果发表在Nature Cancer杂志上。
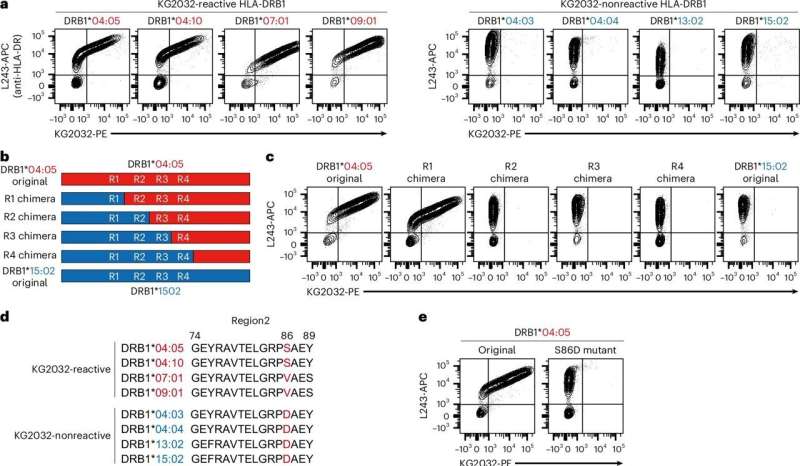
在基于 CAR 的疗法中,T 细胞经过基因改造后靶向和杀死表达特定分子的细胞。CAR-T 细胞在 B 细胞白血病/淋巴瘤和多发性骨髓瘤(MM)患者中取得了巨大成功。然而,目前在针对AML的临床试验中的大多数 CAR-T 细胞靶点在正常细胞类型中也有表达,从而导致潜在的毒性。
论文第一作者Shunya Ikeda说, 在我们之前的MM研究中,我们筛选了单克隆抗体(mAb),以找出能与人类MM样本发生反应但不能与正常血细胞发生反应的抗体。我们的目标是用同样的策略找到AML特异性抗原。
研究小组开始筛选数千种针对AML细胞的 mAb,最终缩小到 32 种能与AML细胞特异性结合的 mAb。其中一种名为KG2032的mAb在超过50%的患者样本中与AML细胞明确结合。通过测序策略,他们确定 KG2032 与 HLA-DRB1 结合。
论文通讯作者Naoki Hosen 解释说, 有趣的是,我们发现 KG2032 与一个特定的 HLA-DRB1 子集发生了反应,在这个子集中,该蛋白质的第 86 位氨基酸是除天冬氨酸之外的氨基酸。因此,KG2032只会对HLA-DRB1不匹配的个体的AML细胞产生反应,这意味着患者携带这个氨基酸残基,而allo-HCT供者不携带。 (100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 5年生存率不足10%,“癌王”难治的原因找到了!《自然》子刊发现它们有特殊入侵方式 (2025-10-02)
- Science:迄今最大规模人类蛋白互作图谱发布!系统鉴定了17849组高置信度蛋白互作,其中3631组为全新首次发现 (2025-10-02)
- Nat Neurosci: 激素调控月经周期中的全脑结构动态 (2025-10-02)
- Adv Sci:空军军医大学黄静等人研究阐明ACC依赖机制连接牙颌结构异常与慢性疼痛-情绪共病 (2025-10-02)
- 长寿可以遗传?《科学》研究发现某些优势或能传到第四代 (2025-10-02)
- Nat Commun:南方医科大学张先荣研究发现巨噬细胞双调蛋白诱导脓肿附近脂肪前体细胞肌成纤维细胞转变 (2025-10-02)
- Nature:新研究鉴定出蛋白LRP8是蜱传脑炎病毒入侵人类脑细胞的受体 (2025-10-02)
- PNAS:金浩杰团队等揭示癌症靶向治疗新策略——靶向VCP,“诱导+清除”衰老细胞双管齐下 (2025-10-01)
- 《自然》:科学家发现,无精氨酸/脯氨酸饮食联合二氟甲基鸟氨酸,可让神经母细胞瘤翻译停滞,提升疗效 (2025-10-01)
- Cell:细菌可将对过去环境的记忆代代相传 (2025-10-01)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















