近期科学家们在类器官研究领域取得的新进展! |
 |
类器官研究领域取得的新进展!
在人类多种疾病的研究与治疗探索中,类器官作为新兴的研究模型,为科学家们打开了一扇新的大门。本文中,小编对近期科学家们在类器官研究领域取得的新进展进行整理,分享给大家!
【1】
doi:10.1002/advs.202407945
在医学研究的前沿领域,肝脏类器官的研究不断取得新的突破,为肝脏疾病的治疗带来了新的希望。近期刊载在Adv Sci (Weinh)的一项研究High-Throughput Formation of Pre-Vascularized hiPSC-Derived Hepatobiliary Organoids on a Chip via Nonparenchymal Cell Grafting聚焦于肝脏类器官的预血管化,其成果为再生医学的发展注入了新的活力。
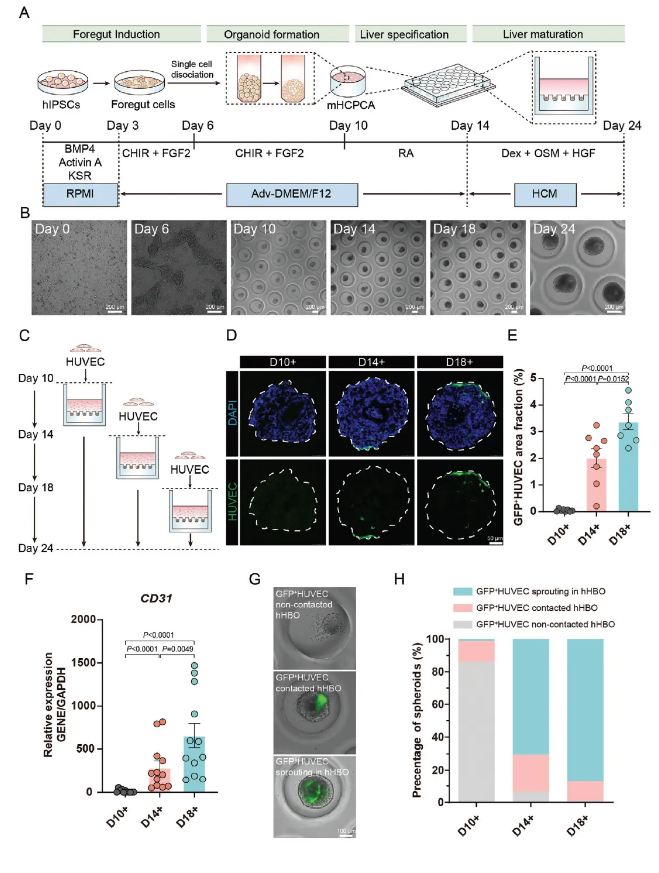
血管化人肝胆类器官(vhHBOs)的内皮细胞移植研究
本研究通过微制造六边形紧密堆积腔阵列(mHCPCA)芯片,成功构建了一个高效的类器官培养体系。在这个体系中,人诱导多能(hiPSCs)经过一系列调控步骤,先分化为前肠干细胞(hFSCs),进而转化为人肝胆类器官(hHBOs)。这一过程在无基质胶的环境下完成,为后续研究奠定了坚实基础。
内皮细胞移植是本研究的核心环节之一。在hHBOs分化的不同阶段,即第10、14和18天,研究人员分别引入绿色荧光蛋白标记的人脐静脉内皮细胞(GFP+HUVECs)。实验结果显示,在肝成熟阶段(第18天)进行内皮细胞移植时,其在hHBOs中的整合效率达到最佳。通过对内皮细胞标记物CD31的mRNA水平检测以及对类器官切片中GFP+HUVEC覆盖面积的分析,均有力地证实了这一结论。更为重要的是,这一过程并未对肝实质细胞的分化产生不良影响,肝细胞特异性标志物如ALB、AFP和HNF4 等的表达保持稳定,确保了肝脏类器官在实现预血管化的同时,维持了其正常的生物学功能。
【2】
doi:10.1038/s41467-025-58295-3
在神经系统疾病的研究与治疗探索中,大脑类器官作为新兴的研究模型,为我们打开了一扇新的大门。它能在体外模拟人类大脑的发育过程,帮助科研人员深入了解大脑的奥秘。然而,目前大脑类器官的发展面临着一个关键问题 缺乏适当的成熟度,这在很大程度上限制了其在科研和临床领域的应用。发表于Nat Commun的一项研究Astrocyte-secreted cues promote neural maturation and augment activity in human forebrain organoids为解决这一难题带来了新的希望。
此前,为了提升大脑类器官的成熟度,科研人员尝试了多种方法。像运用机械切片、高氧培养等物理手段,以及补充生长因子、整合不同细胞类型等生化方法,这些尝试虽取得了一定成果,但在提升成熟度的效率和可扩展性方面仍不尽人意。而星形胶质细胞分泌的信号,在神经回路的形成、成熟和可塑性方面起着关键作用,这让科研人员将目光聚焦于此,期望从中找到提升大脑类器官成熟度的有效途径。
在这项研究中,科研人员将星形胶质细胞分泌的因子融入到人类多能干细胞(hPSC)衍生的2D和3D神经培养系统中,构建了经星形胶质细胞条件培养基(ACM)处理的前脑类器官(MACMO)模型。他们先通过比较和整合先前的分化方案,成功开发出从hPSCs生成前脑类器官的方法,并使用多种PSC系进行实验,确保结果的可靠性。
【3】
doi:10.1126/science.adu9375
2009年,荷兰 Hubrecht 研究所的 Hans Clevers 等人使用来自小鼠肠道的成体干细胞培育出首个肠道类器官,开创了类器官研究时代。此后,类器官领域研究成果不断,许多新型类器官和更复杂的类器官不断涌现,大脑类器官用于研究神经发育障碍、肠道类器官用于模拟乳糜泻、肺类器官用于研究,甚至还有心脏类器官被送到国际空间站以测试微重力对心肌的影响,这些研究新药开发、治疗、再生医学等领域带来了更强大的工具。
然而,有一个问题一直困扰着类器官研究领域 类器官通常不到绿豆大小,与人体内的器官不同,类器官没有血管系统来为每个细胞输送氧气和营养物质,直径超过大约 3 毫米时,类器官就无法再通过直接从周围环境中吸收资源来维持自身,就会从内部开始细胞死亡。近日,斯坦福大学医学院吴庆明(Joseph C. Wu)教授团队在国际顶尖学术期刊Science上发表了题为:Gastruloids enable modeling of the earliest stages of human cardiac and hepatic vascularization 的研究论文。
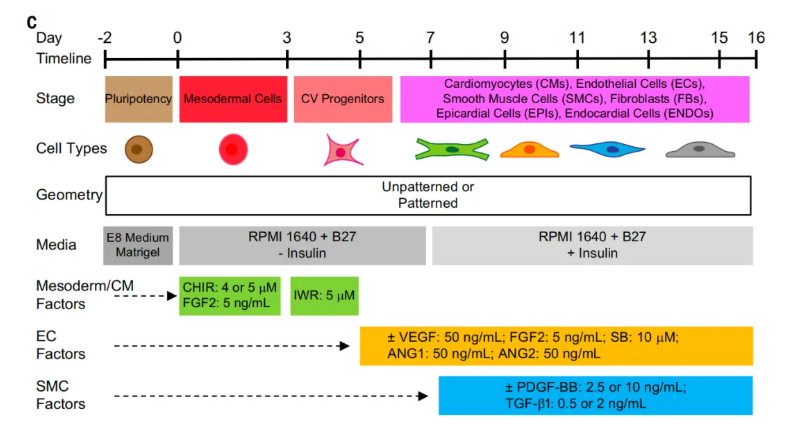
该研究开发了一种将人类多能干细胞(hPSC)培养为血管化心脏类器官和血管化肝脏类器官的方法,克服了类器官领域的重大瓶颈,不仅能够让类器官长得更大,还能使其达到更成熟阶段,从而使其作为生物模型更具实用性,不仅可用于研究心脏和肝脏发育,还可用于研究药物暴露对人体器官发育的影响。论文通讯作者吴庆明教授表示,未来,或许可以从患者自身的干细胞培育出血管化的心脏类器官,并通过外科手术植入心脏中,以替换受损或缺失的心肌组织。类器官有了有血管系统,就能与宿主的血管系统相连,这样植入后存活的机会就会更大。
【4】
doi: 10.1038/s41586-025-08861-y
庆应义塾大学医学院佐藤俊朗教授团队在国际顶尖学术期刊Nature上发表了题为:Generation of human adult hepatocyte organoids with metabolic functions 的研究论文。该研究从直接取自人类患者的冷冻保存的成人肝细胞中培养出了具有代谢功能的成人肝细胞类器官。研究团队使用参与炎症反应的信号蛋白抑瘤素M(Oncostatin-M,OSM)进行处理,使得肝细胞类器官的增殖量达到了百万倍,这与之前研究中的肝细胞几乎不生长的情况形成了鲜明对比。这些肝细胞类器官持续生长了三个月,并且在半年内仍保持分化能力。这些肝细胞类器官为肝脏疾病的建模和治疗提供了新平台。
在这项最新研究中,研究团队从直接取自人类患者的冷冻保存的成人肝细胞中培养出了成人肝细胞类器官,并证明了 Wnt 和 STAT3 信号通路的联合激活能够使人类成人肝细胞类器官实现长期自我更新,YAP 激活能够促进肝细胞的增殖,但也会使其向胆管细胞谱系分化。相比之下,由抑瘤素M(Oncostatin-M,OSM)激活的 STAT3 能诱导肝细胞增殖(增殖量可达百万倍),同时抑制胆管化生并维持肝脏特性。
研究团队表示,发现抑癌素M在类器官发育中的作用,是一项关键突破。在去除生态位因子并补充激素后,这些肝细胞类器官会形成类似索状结构,并具有胆小管网络,具有了肝脏的所有主要功能,能够产生葡萄糖、尿素、胆汁酸、和甘油三酯等化合物以及白蛋白,其主要的肝脏代谢功能与体内肝细胞相当。
【5】
doi:10.1126/science.adt1438
75% 以上影响人类的新传染病最初都来自动物。尤其是蝙蝠,它们是一些世界上最危险病毒的天然宿主,包括导致 的病毒SARS-CoV-2、MERS-CoV、甲型流感病毒和汉坦病毒。然而,尽管这些病毒非常重要,科学家们长期以来一直在努力研究它们在蝙蝠体内的行为方式,原因很简单,因为没有合适的生物工具。
在此之前,大多数研究使用的都是通用的细胞样本,或者只从一种热带果蝠身上制作的类器官,而且是仅针对一种器官制作的。但是,突破性进展已经到来:如今,由韩国基础科学研究所(IBS)领导的一个研究小组与国际合作者共同创建了世界上最全面的蝙蝠类器官平台。相关研究结果发表在Science杂志上。这些 微型器官 是从亚洲和欧洲发现的五个常见蝙蝠物种中培育出来的,代表了四个不同的器官 气道、肺部、肾脏和小肠。
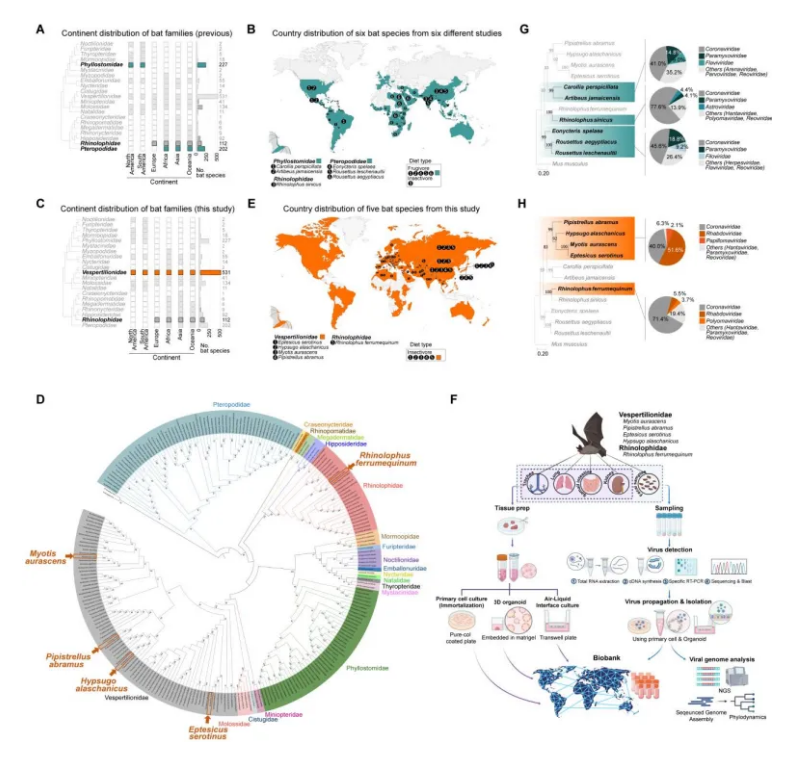
当前和以往研究中蝙蝠物种的分布和系统发育分析
IBS基因组工程中心主任 Koo Bon-Kyoung 说, 在实验室中重建蝙蝠器官的生理结构,让我们能够以前所未有的细节探索人畜共患病病毒 那些从动物跳到人类身上的病毒,是如何工作的。
有了这些新工具,研究人员就能直接测试关键病毒,包括 SARS-CoV-2、MERS-CoV、甲型流感病毒和汉坦病毒--如何感染不同的蝙蝠物种和器官。他们发现,每种病毒都有独特的表现,有时只感染某些器官或蝙蝠种类。例如,一种病毒很容易在一种蝙蝠的肺部生长,但在另一种蝙蝠的肾脏中却无法生长。这有助于解释为什么有些病毒可以传染给人类,而另一些病毒的宿主却只能局限于蝙蝠。
【6】
doi:10.1038/s41467-024-55567-2
在构建类器官时,维持干细胞自我更新和分化的平衡是一项微妙的艺术。就像调音师调整乐器的每一个弦一样,研究人员需要精确调控干细胞的行为,以确保类器官既能快速生长又能保持细胞多样性。然而,在实验室环境中模拟体内复杂的空间生境梯度并非易事。
近日,一篇发表在国际杂志Nature Communications上题为 A tunable human intestinal organoid system achieves controlled balance between self-renewal and differentiation 的研究,揭示了一种新方法,使得这一挑战迎刃而解。来自中国同济大学的研究团队开发了一种可调节的人类肠道类器官系统,该系统能够在干细胞自我更新和分化之间实现可控的平衡。通过使用小分子通路调节剂组合,研究者不仅增强了类器官干细胞的干性(即维持未分化状态的能力),还增加了细胞的多样性,这一切都不依赖于人为创建的空间或时间信号梯度。
为了更好地理解这一点,可以将这个过程想象成一场交响乐演出。每个干细胞就像是乐团中的一员,而小分子通路调节剂则是指挥棒,引导着每个细胞在合适的时间演奏正确的音符。在这个比喻中,BET抑制剂、Wnt、Notch和BMP等信号因子就像是不同的音乐章节,指导着细胞从一个类型转变为另一个类型,比如从分泌细胞分化为肠细胞谱系。这种转换是有效且可逆的,意味着细胞可以根据需要灵活地改变命运。传统上,培养成人干细胞(ASC, adult stem cell)衍生的类器官面临两大难题:要么干细胞过度自我更新导致细胞种类单一;要么促进分化后增殖能力下降。这就像是厨师试图同时煮沸两锅水,却只能选择一锅加热到高温,另一锅则保持低温。但在这项研究中,科学家们找到了一种方法,可以在同一锅中同时达到两种目的 既保证了类器官的快速扩展,又增加了细胞类型的丰富性。
【7】
doi:10.1039/d4ra08290g
器官芯片设备(Organ-on-a-chip devices)通常由一种名为聚甲基硅氧烷(PDMS,polymer polymethylsiloxane)的聚合物制成。这种材料透明、透气且生物相容性良好,但细胞在上面的吸附却是个难题,尤其是对于那些娇嫩的原代细胞,比如小肠类器官衍生的上皮细胞。
近日,一篇发表在国际杂志RSC Advances上题为 Enhanced small intestinal organoid-derived epithelial cell adhesion and growth in organ-on-a-chip devices 的研究报告中,来自瑞典隆德大学等机构的科学家们成功攻克了这一难题。他们提出了一种在PDMS和细胞培养塑料表面生成小肠类器官衍生单层组织的方案,通过探索多种PDMS表面功能化方法、不同粘附蛋白和培养基配方,找到了能让细胞完美粘附并形成100%融合单层组织的 黄金组合 。
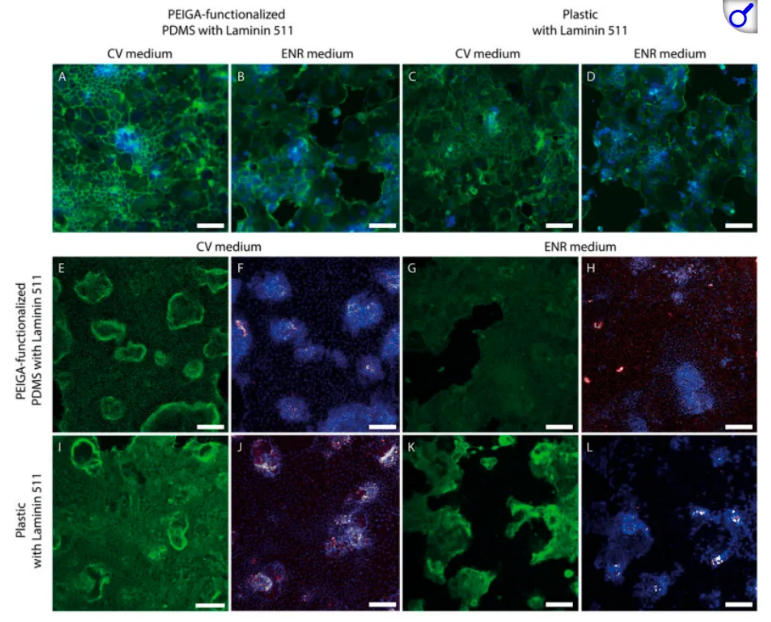
小鼠小肠上皮在第6天时的代表性图像
研究人员发现,最佳方案是使用聚乙烯亚胺-戊二醛(PEIGA)功能化的PDMS,搭配层粘连蛋白511或与胶原I联合作为粘附蛋白底物,并在特殊培养基中培养。这一组合能让小肠类器官衍生的上皮细胞实现最高的生长速率和细胞覆盖率。更令人惊喜的是,这种方法不仅适用于小鼠细胞,还能扩展到人类小肠类器官衍生的细胞,为两种物种的细胞培养和生长提供了通用平台。
【8】
doi:10.1038/s41598-025-88082-5
头颈部鳞状(HNSCC)是一类高发且致命的,治疗相关毒性显著,美国癌症协会数据显示,2023年该国新增口腔、咽和病例超6.6万例,死亡病例超1.5万例。这类癌症分子异质性强,95%以上为鳞状细胞癌,存在TP53、CDKN2A等抑癌基因失活及EGFR、HRAS等癌基因激活等广泛遗传异常,复发或转移患者中位生存期仅14.9个月,且多数对放化疗存在耐药性。
为解决这一临床困境,发表于Sci Rep的研究Head and neck tumor organoid grown under simplified media conditions model tumor biology and chemoradiation responses构建了患者来源类器官(PDO)模型,其以无WNT培养基为核心技术亮点。与传统含Wnt激动剂的培养基不同,该模型避免加入Wnt3a或CHIR99021,因HNSCC的Wnt通路激活程度远低于等,此举可维持肿瘤分化状态,减少干细胞样表型,保留肿瘤异质性。培养基含牛垂体提取物、EGF、FGF等成分,支持类器官生长,抑制成纤维细胞过度增殖。
研究招募51例患者,处理34份肿瘤组织,以能传代4次以上为成功标准,PDO建立成功率超40%。PDO在多方面与原发肿瘤高度一致,组织病理学上,再现了巢结构、keratin pearls等特征,如Pt#003的PDO保留了原发肿瘤的基底样细胞与成熟细胞分层;分子层面,p16表达状态与HPV感染状态一致,CD44、KRT5等标志物表达相符;基因组层面,全外显子测序显示PDO与原发肿瘤的SNV、CNV高度相似,共享TP53等关键基因突变。
【9】
doi:10.1007/s12264-025-01429-w
在神经内科门诊,医生常常面临这样的困境:同样是癫痫患者,携带离子通道基因突变的个体对药物的反应却大相径庭。作为神经系统疾病领域的重要研究方向,遗传癫痫尤其是通道病相关癫痫的精准治疗一直是临床难题。
近日,Neurosci Bull的一项研究Human Cortical Organoids with a Novel SCN2A Variant Exhibit Hyperexcitability and Differential Responses to Anti-Seizure Compounds为这一困境提供了新的解决思路 研究团队利用患者来源的新型SCN2A突变(p.E512K)构建了皮层类器官模型,不仅揭示了神经元超兴奋性的电生理机制,更首次证明这类个体化类器官可作为抗癫痫药物临床前评估的高效平台。
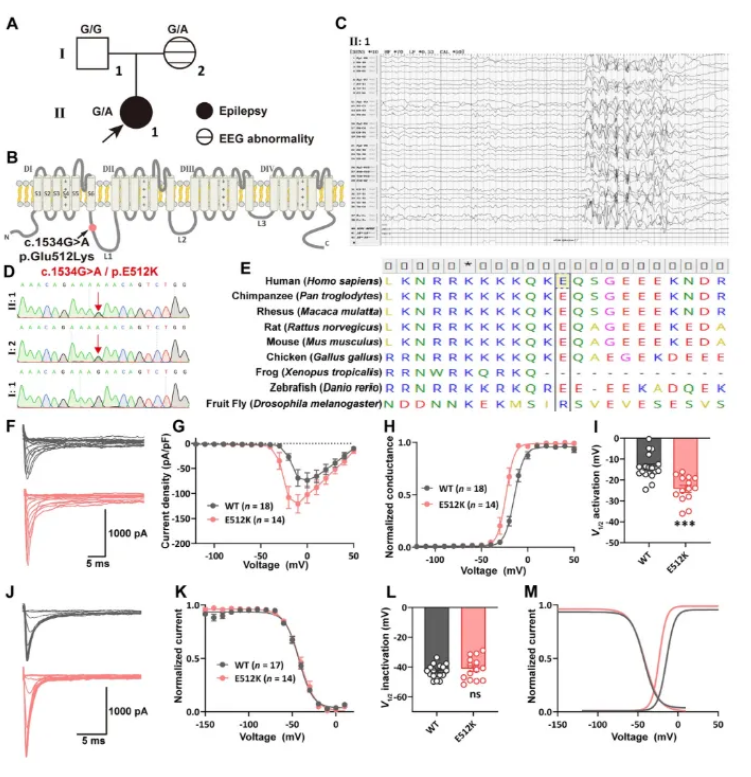
SCN2A E512K变异的鉴定与表征
电压门控钠离子通道(VGSCs)基因变异是遗传癫痫的主要致病因素,其中SCN2A编码的Nav1.2通道在神经发育早期至成熟期均发挥关键作用。既往研究表明,SCN2A突变可通过功能获得(GoF)或功能丧失(LoF)两种机制引发癫痫,但由于异源细胞模型与真实神经元环境的差异,部分突变的功能表型仍存在争议。
本研究首先在HEK293T细胞中验证了新型突变p.E512K的电生理特性:与野生型相比,突变型Nav1.2通道的钠电流密度显著增加(野生型-73.6 14.8 pA/pF vs 突变型-120.6 18.5 pA/pF,P 0.0001),且激活电压阈值显著左移(半激活电压从-13.8 1.4 mV降至-24.3 1.7 mV),提示该突变通过GoF机制增强通道活性。值得注意的是,稳态失活曲线未出现显著变化,但突变型通道的窗口电流范围明显拓宽,这可能是导致神经元持续去极化的关键因素。
【10】
doi:10.1016/j.stemcr.2025.102537
在日常生活中,阿尔茨海默病(AD)如同一朵笼罩在老年群体头顶的乌云,其进行性认知衰退的特征让无数家庭备受煎熬。我们都知道,APOE4是AD的主要遗传风险因子,可它究竟是如何在人体内埋下疾病隐患的呢?近日,Stem Cell Reports刊登的一项研究APOE4 impacts cortical neurodevelopment and alters network formation in human brain organoids借助人类诱导多能干细胞(iPSC)衍生的脑类器官,为我们揭开了APOE4在大脑发育早期 搞破坏 的神秘面纱。
APOE4作为AD最强的遗传风险因子,其影响远比我们想象的更早。研究表明,APOE4携带者在婴儿期就已出现脑结构的持续性改变,这种改变甚至会延伸至青春期之后。为了深入探究APOE4对神经发育的影响,科研人员利用iPSC构建了皮质类器官(COs)和神经节隆起类器官(GEOs),分别富集兴奋性和抑制性神经元,从细胞和功能层面解析APOE4的作用机制。
在皮质类器官中,APOE4展现出对神经细胞 此消彼长 的调控能力。随着发育进程,APOE4显著减少了皮质上层神经元(如SATB2+和BRN2+神经元)的数量,同时却促进了星形胶质细胞(GFAP+、ALDH1L1+、SOX9+)和外层放射状胶质细胞(HOPX+ oRG)的增殖。这种变化与基因表达谱的改变相呼应,APOE4皮质类器官在神经发生和胶质发生阶段,均富集了神经发育和胶质生成相关的转录程序,提示APOE4可能推动了细胞命运从神经发生向胶质发生的转变。值得注意的是,APOE4皮质类器官在发育后期还出现了细胞死亡增加的现象,尽管这并非神经元减少的唯一原因,却进一步加剧了神经细胞的损耗。(100yiyao.com)
100医药网更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制 (2025-09-11)
- 构建中国人衰老时钟,200多位中国学者联合推出X-Age项目(耄耋计划),推动健康长寿研究 (2025-09-11)
- 参天公司青光眼引流器"港澳药械通"上市许可获广东省药监局批准 (2025-09-10)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















