真实世界证据助力药物研发与审评 明确六大应用范围! |
 |
医药网1月8日讯 1月7日,《国家药监局关于发布真实世界证据支持药物研发与审评的指导原则(试行)的通告》(2020年第1号)挂网(下称《指导原则》)。去年5月,国家药监局曾发布《真实世界证据支持药物研发的基本考虑(征求意见稿)》(下称《意见稿》),经过数月广泛征求意见,最终形成《指导原则》。
对比发现,在最受业界关注的应用范围上,也就是真实世界证据(RWE)支持药物研发和监管决策方面,从之前《意见稿》所规定的罕见病治疗药物、修订适应症或联合用药范围、上市后药物的再评价、我国特有现象——中药医院制剂的临床研发、指导临床研究设计、精准定位目标人群的六种情形,修订为适用于:新药注册上市提供有效性和安全性证据、为已上市药物的说明书变更提供证据、为药物上市后要求或再评价提供证据、名老中医经验方和中药医疗机构制剂的人用经验总结与临床研发,以及指导临床研究设计、精准定位目标人群等范围。
明确RWE适用范围
近年来,随着一系列改革措施推进落实,药物研发快速发展,新药加速上市,同时对药物研发工作的质量和效率提出了更高的要求。如何利用真实世界证据评价药物的有效性和安全性,成为国内外药物研发和监管决策中日益关注的热点问题。
其中,真实世界证据的适用范围有待明确。真实世界证据与传统随机对照临床试验(RCT)提供的证据均可以是药物监管决策证据的组成部分,支持监管决策形成综合、完整而严谨的证据链,从而提高药物研发和监管的科学性和效率。因此,需要根据药物研发和监管的现实情况明确真实世界证据的适用范围,并能够随现实情况变化进行调整。
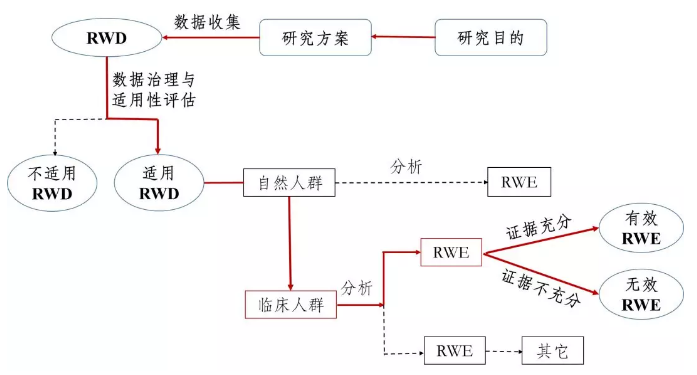
支持药物监管决策的真实世界研究路径(实线所示)
最新发布的《指导原则》主要包括了六个部分:真实世界研究的相关定义、真实世界数据的来源和适用性、真实世界证据支持药物监管决策、真实世界研究的基本设计、真实世界证据的评价与审评机构的沟通交流。
在真实世界证据支持药物监管决策的应用范围上,《指导原则》在《意见稿》规定的适用情形的基础上进行了调整,应用范围主要包括:
一、为新药注册上市提供有效性和安全性的证据
根据不同疾病的特征、治疗手段的可及性、目标人群、治疗效果和其它与临床研究相关的因素等,可以通过真实世界研究获得药物的效果和安全性信息,为新药注册上市提供支持性证据。
常见的为新药注册上市提供有效性和安全性证据的真实世界研究有:使用真实世界数据获得的结局或安全性数据的随机临床试验,包括PCT设计等;以及针对某些缺乏有效治疗措施的罕见病和危及生命的重大疾病,而采用基于真实世界证据作为外部对照的单臂临床试验。
二、为已上市药物的说明书变更提供证据
对于已经上市的药物,新增适应症通常情况下需要RCT支持。但当RCT不可行或非最优的研究设计时,采用实用临床试验(PCT)或观察性研究等生成的真实世界证据支持新增适应症可能更具可行性和合理性。在儿童用药等领域,利用真实世界证据支持适应症人群的扩大也是药物监管决策可能适用的情形之一。总的来说,真实世界证据支持已上市药物的说明书变更主要包括以下几种情形:
1.增加或者修改适应症;2.改变剂量、给药方案或者用药途径;3.增加新的适用人群;4.添加实效比较研究的结果;5.增加安全性信息;6.说明书的其它修改。
三、为药物上市后要求或再评价提供证据
基于RCT证据获批的药物,通常由于病例数较少、研究时间较短、试验对象入组条件严格、干预标准化等原因,存在安全性信息有限、疗效结论外推不确定、用药方案未必最优、经济学效益缺乏等不足,需要利用真实世界数据对药物在真实医疗实践中的效果、安全性、使用情况,以及经济学效益等方面进行更全面的评估,并不断根据真实世界证据做出决策调整。
四、名老中医经验方、中药医疗机构制剂的人用经验总结与临床研发
对于名老中医经验方、中药医疗机构制剂等已有人用经验药物的临床研发,在处方固定、生产工艺路线基本成型的基础上,可尝试将真实世界研究与随机临床试验相结合,探索临床研发的新路径。
应用真实世界证据支持已有人用经验中药的临床研发策略可以有多种,应根据产品的特点、临床应用情况以及数据适用性等方面的考虑,选择不同的研发策略。例如可以探索将观察性研究(包括回顾性和前瞻性)代替常规临床研发中I期和/或II期临床试验,用于初步探索临床疗效和安全性;在观察性研究的基础上,再通过RCT或PCT进一步确证已有人用经验中药的有效性,为产品的注册上市提供支持证据。如果经过评价,存在适用的高质量真实世界数据,且通过设计良好的观察性研究形成的真实世界证据科学充分,也可与药品监管部门沟通,申请直接作为支持产品上市的依据。
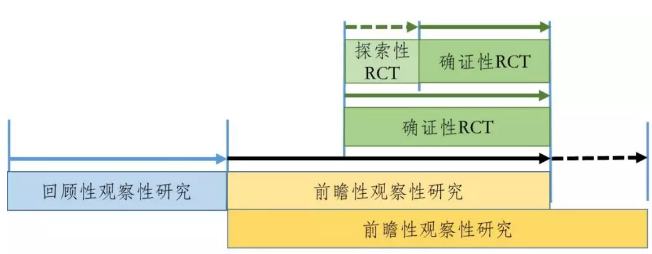
已有人用经验中药临床研发的路径之一

已有人用经验中药临床研发的路径之二
五、真实世界证据用于监管决策的其它应用
1.指导临床研究设计
利用真实世界证据指导临床研究设计有着现实的用途。真实世界证据可为入选和排除标准、样本量估计的参数、非劣效界值的确定等提供有效的参考依据,有助于审评中对设计合理性的判断。
2.精准定位目标人群
精准医疗旨在更好地预测药物对特定人群(亚组)的治疗获益和风险,基于真实世界数据的真实世界证据为精准医疗提供了可能。
除了上述应用范围,《指导原则》亦明确真实世界证据应用于支持药物监管决策,涵盖上市前临床研发以及上市后再评价等多个环节,也不排除其它合理的应用。
RWE已在药品审评中应用
此外,《指导原则》也在附件中列出了两件真实世界证据应用案例。
示例1:利用真实世界证据支持新增适应症
申办方在某药上市后发起一项通过真实世界数据评价其在中国女性中减少临床骨质疏松性骨折的有效性和安全性研究。该研究遵循真实世界研究的良好实践,研究方案事先公开。真实世界数据来源具有良好的研究人群代表性,样本量达4万余人,该研究的主要终点通过病历审查进行验证,以倾向评分匹配作为主要分析方法,同时使用逆概率加权法、高维倾向评分调整等多种方法进行敏感性分析,并定量评估未测量到的混杂因素的影响。该真实世界研究的结果与全球RCT研究相近,并用不同数据来源、不同研究机构的真实世界数据重现出该结果。
示例2:利用真实世界证据支持扩大联合用药
贝伐珠单抗(Bevacizumab)是一种血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)人源化单克隆抗体制剂,于2015年在中国获批联合化疗(卡铂与紫杉醇)用于不可切除的晚期、转移性或复发性非鳞状非小细胞肺癌患者的一线治疗。真实世界中患者所联合的化疗方案并不局限于卡铂与紫杉醇,还包括培美曲塞联合铂类、吉西他滨联合顺铂等。2018年10月该药获批将治疗方案扩展为联合以铂类为基础的化疗方案,其中三项真实世界研究结果提供了强有力的支持证据。这三项研究回顾性分析了三家医院的患者数据,均显示在含铂双药化疗基础上联合贝伐珠单抗较单纯化疗显著延长PFS和OS,与全球人群数据具有一致性,并且未发现新的安全性问题。此外,相关真实世界研究还提供了EGFR突变和脑转移等不同患者亚组中的疗效数据,从多角度证实了贝伐珠单抗联合疗法的有效性和安全性。
医药网新闻
- 相关报道
-
- 121种药通过初审 国度医保局将初次订定商保立异药目次 (2025-08-14)
- 市场监管总局:2025年上半年医疗告白守法案件罚没金额1278万元 (2025-08-14)
- 国度医保局地下宣布第五批智能监管“两库”规定和常识点 (2025-08-14)
- 534个药品通过2025年国度医保药品目次模式审查 (2025-08-13)
- 中国立异药:从根底研讨莅临床利用 不时加强的环球竞争力 (2025-08-13)
- 云南辅助生殖归入医保报销已惠及近2万家庭 (2025-08-12)
- 首项医疗保证畛域国度尺度宣布 来岁1月1日起施行 (2025-08-11)
- 西医药在基孔肯雅热的防控方面有何劣势?专家解答 (2025-08-06)
- 湖南颁布下层医疗卫生气希望构五类疾病药品推销清单 (2025-08-06)
- 湖南展开2025年度医疗机构制剂目次调整任务 (2025-08-06)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















