研究揭示H2A.Z染色质组装的新机制 |
 |
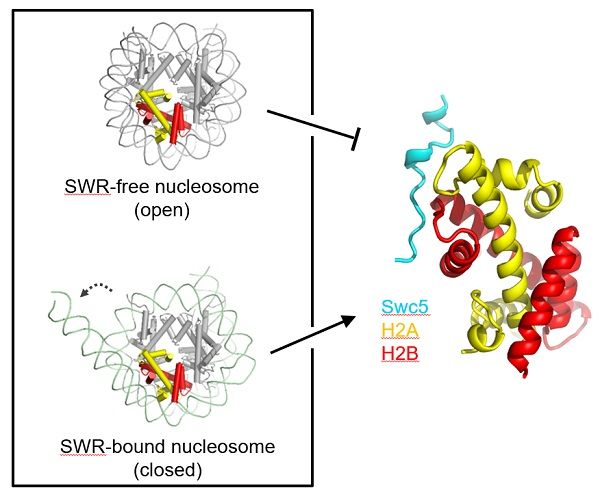
1月30日,《美国国家科学院院刊》(PNAS)在线发表了中国科学院生物物理研究所周政课题组的研究论文“Role of a DEF/Y motif in histone H2A-H2B recognition and nucleosome editing”。该研究揭示了SWR复合物亚基Swc5特异性识别组蛋白H2A-H2B并调控组蛋白H2A.Z进行染色质组装的分子机制。H2A.Z是组蛋白H2A的一类变体。及哺乳动物细胞中的H2A.Z具有高度保守的序列,并且在基因转录、DNA复制、基因组稳定性维持等过程中发挥重要作用。H2A.Z通过精确定位于基因组的特定位点来改变染色质结构并实现其功能。染色质重塑复合物SWR通过水解ATP释放能量,逐步将转录起始位点附近的H2A核小体替换成H2A.Z核小体,从而实现H2A.Z的染色质定位。为了阐明SWR的功能以及H2A.Z的染色质定位机制,近年来周政课题组对H2A.Z交换反应进行了深入研究,先后揭示了H2A.Z移除(Cell Res 2014)、SWR亚基YL1调控H2A.Z组装(Nat Struct Mol Biol 2016)、组蛋白伴侣Chz1调控H2A.Z组装(PLoS Biol 2019)等重要机制。现有研究表明,在SWR催化H2A.Z-H2B组装进入核小体的同时,H2A-H2B会从核小体上发生移除。在此过程中,SWR亚基Swc5对H2A-H2B的识别发挥着重要作用,但其分子机制尚不清楚。通过测定来源的Swc5与H2A-H2B的晶体结构,研究人员发现Swc5及其哺乳动物同源蛋白CFDP1均利用一个串联的DEF/Y基序识别H2A-H2B。结构显示Swc5利用中心的极性氨基酸辅以两端的疏水氨基酸形成其特有的“三齿模型(tridentatemode)”牢固结合H2A-H2B,同时保证其选择性识别常规组蛋白H2A而非变体组蛋白H2A.Z。通过等温量热滴定、体外酶活测定以及体内交联等实验,研究人员证实DEF/Y基序在识别H2A-H2B、促进组蛋白交换、调节SWR催化活性等过程中具有重要作用。该研究提示,当SWR复合物催化H2A.Z交换反应时,核小体DNA打开并暴露出H2A-H2B上的Swc5结合位点,Swc5识别并结合H2A-H2B会促进后者从核小体上移除,从而确保H2A.Z交换反应的顺利进行(图1)。该研究为阐明SWR复合物的功能以及H2A.Z的染色质定位机制奠定了基础。( 100yiyao.com)
医药网新闻

- 相关报道
-
- 十大护肝片排行第一名品牌推荐,护肝片哪个牌子效果最好?核心成分、锁鲜技术、售后保障精准作用于肝脏 (2025-08-16)
- Cell重磅:AI破局抗生素耐药危机,从头设计全新抗生素,精准杀灭耐药菌 (2025-08-16)
- 30岁男性抗初老指南,如有枣蟹可用爱廷玖盐酸达泊西汀片 (2025-08-15)
- Zn通过提高AKT甲基化改善仔猪肠道屏障功能障碍方面取得新进展 (2025-08-15)
- 中国团队突破同位素Ac-225量产技术!清华大学联合磐美迪破解全球供应困局 (2025-08-15)
- 2025年护肝片排行第一名官方旗舰店花落谁家?成分技术口碑全解析 (2025-08-15)
- 2025年度护肝片十强深度测评:成分安全与效果兼顾的优选榜单 (2025-08-15)
- 氨糖软骨素钙片质量排行榜:这份选购参考帮你理清思路 (2025-08-15)
- 将服务送到群众“家门口”——重视庆下层医疗卫生气希望构新变动 (2025-08-15)
- Nature子刊:尧唐生物吴宇轩等开发LNP-mRNA疗法,实现体内造血干细胞基因编辑 (2025-08-15)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















