科伦、东阳光药、正年夜晴和......12个重磅首仿将获批 |
 |
医药网2月19日讯 2021年,疫情的阴郁还未完整消退,多国新冠疫苗研发疾速推动,为环球经济带来愿望。中国经济率先苏醒,医药界频出重拳。年终,国度医保局宣布“两定方法”,虽说网售处方药有待明白,但批发行业仍看到了利好。春节前,第四批药品集采开标,集采常态化继续影响医药行业的倒退,进一步倒逼企业立异转型。3月1日起,新版医保药品目次正式启用,药企的日子将加倍艰巨。2021,砥砺前行,方见曙光!本期推出重磅首仿获批预测,以飨读者。
首仿药具备市场和订价劣势,是国际药企规划的重点畛域。跟着新药审评审批轨制改造,首仿药获批速率日渐放慢。米内网数据显示,新年伊始,已有超过10款首仿药(含剂型首仿)获批上市,包含恒瑞的盐酸右美托咪定氯化钠打针液、齐鲁的曲氟尿苷替匹嘧啶片及二甲双胍维格列汀片、上海宣泰海门的泊沙康唑肠溶片、天士力的米诺膦酸片、南京海融的他卡西醇软膏等。那么还有哪些重磅首仿药无望于2021岁尾前获批上市呢?
表1:无望于2021岁尾前诞生首仿的重磅种类
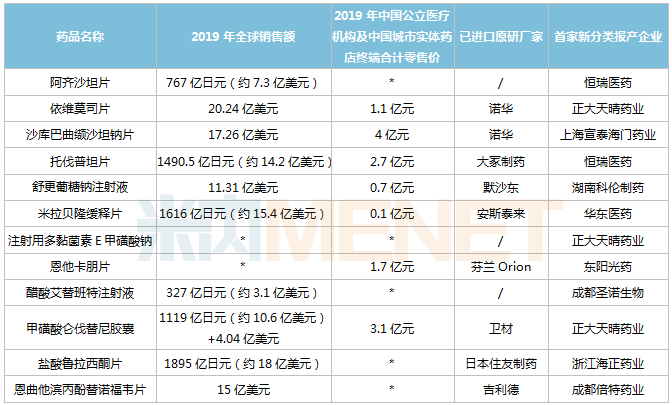
注:无贩卖额或低于1000万元用*代表;预测数据,仅供参考;首家报产纷歧定首家获批
阿齐沙坦片
阿齐沙坦是武田研发的一款血管重要素II(AngII)受体拮抗剂,最早于2011年得到FDA同意上市,用于医治高血压,2019年环球贩卖额达767亿日元。
表2:阿齐沙坦片新分类报产环境
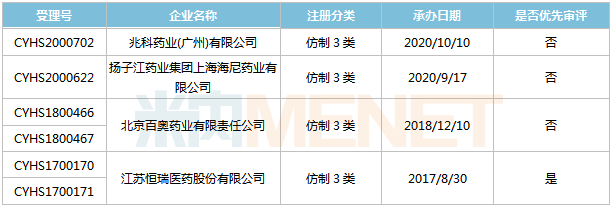
起源:米内网MED2.0中国药品审评数据库
今朝国际有4家企业以仿造3类提交阿齐沙坦片上市申请。恒瑞医药于2017年8月提交该产物上市申请并得到CDE承办受理,为国际首家,同年12月以“专利到期前1年的药品临盆申请”为由归入优先审评,今朝处于第二轮材料发补。此外,百奥药业的产物处于第一轮材料发补。
依维莫司片
依维莫司是由诺华研发的一款哺乳植物雷帕霉素靶卵白(mTOR)克制剂,于2009年在美国获批上市,是FDA同意的首个mTOR克制剂;2013年2月肝移植后排挤反馈的新顺应症获批,是FDA十几年来首个同意的肝移植免疫克制剂。依维莫司2019年环球贩卖额为20.24亿美元。
依维莫司片于2013年1月获批进入国际市场,2017年通过会商归入全国医保目次,2019年景功续约并新增报销顺应症。米内网数据显示,该产物在2019年中国公立医疗机构及中国城市实体药店终端共计贩卖额超过1亿元,同比增长29.5%。
表3:依维莫司片新分类报产环境

起源:米内网MED2.0中国药品审评数据库
今朝国际仅正年夜晴和药业的依维莫司片报产,其上市申请于2018年11月得到CDE承办受理,今朝已分开新报工作,处于第一轮材料发补。
沙库巴曲缬沙坦钠片
沙库巴曲缬沙坦是由沙库巴曲(脑啡肽酶克制剂)和缬沙坦(血管重要素受体拮抗剂)构成的复方制剂,于2015年7月得到FDA同意上市,是环球首款心衰医治畛域的突破性立异药物,2019年环球贩卖额17.26亿美元。
2017年7月,诺华的沙库巴曲缬沙坦钠片获批进入国际市场,今朝已通过会商归入全国医保,2019年在中国公立医疗机构及中国城市实体药店终真个贩卖额超过4亿元,同比增长440.1%。
表4:沙库巴曲缬沙坦钠片新分类报产环境
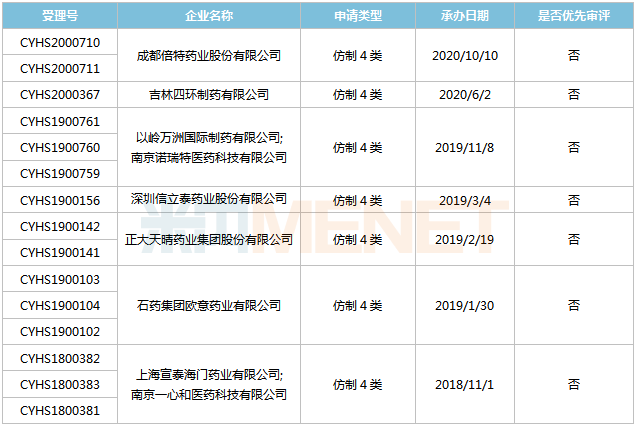
起源:米内网MED2.0中国药品审评数据库
今朝国际有7家企业以仿造4类提交沙库巴曲缬沙坦钠片上市申请,此中上海宣泰海门药业最早报产,其上市申请于2018年11月得到CDE承办受理,今朝正处于第二轮材料发补。此外,石药欧意、正年夜晴和等企业的产物处于第一轮材料发补。
托伐普坦片
托伐普坦这天本年夜冢制药开辟的一款口服选择性精氨酸加压素V2受体拮抗剂,用于医治高容或等容性低钠血症伴心力弱竭、肝软化、抗利尿激素排泄异常综合征等。该产物于2009年5月得到FDA同意上市,是环球首款血管加压素受体拮抗剂,2019年环球贩卖额为1490.5亿日元。
年夜冢制药的托伐普坦片于2011年获批进入国际市场,2017年通过会商归入全国医保目次,但2019年续约会商失败。该产物在2019年中国公立医疗机构及中国城市实体药店终端共计贩卖额为2.7亿元,同比增长46.95%。
表5:托伐普坦片新分类报产环境
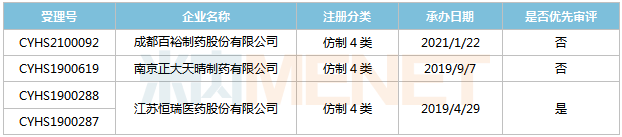
起源:米内网MED2.0中国药品审评数据库
今朝国际有3家企业以仿造4类提交托伐普坦片上市申请,此中恒瑞医药为首家报产,其上市申请于2019年4月得到CDE承办受理,并于同年9月归入优先审评。恒瑞医药、南京正年夜晴和的产物今朝均处于第一轮材料发补。
舒更葡糖钠打针液
舒更葡糖钠是默沙东和欧加农开辟的环球首个特同性联合性神经肌肉阻滞拮抗药物,用于拮抗罗库溴铵或维库溴铵诱导的神经肌肉阻滞。该产物最早于2008年9月在欧盟获批上市,2015年12月在美国获批上市,2019年环球贩卖额为11.31亿美元。
2017年5月,舒更葡糖钠打针液获批进入国际市场,2019年在中国公立医疗机构终真个贩卖额超过7000万元,同比增长804.21%,2020年上半年贩卖额超过5000万元,同比增长117.5%。
表6:舒更葡糖钠打针液新分类报产环境
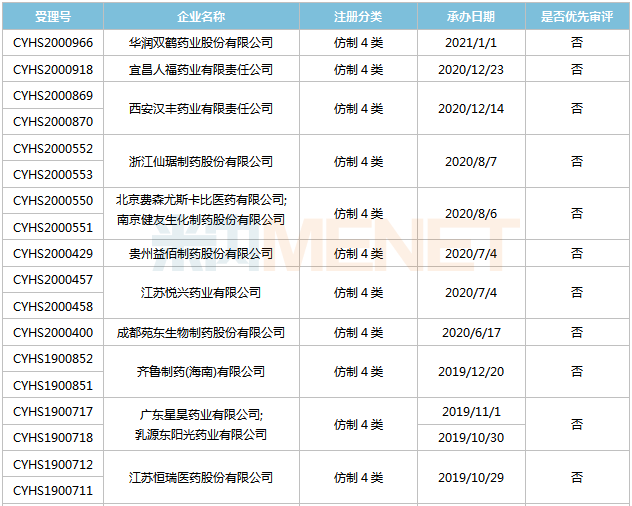
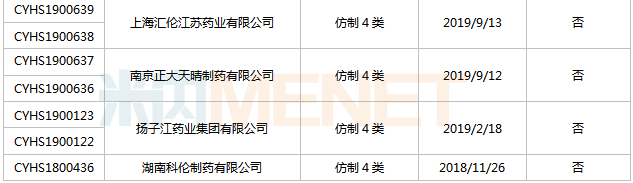
起源:米内网MED2.0中国药品审评数据库
舒更葡糖钠打针液首仿之争较为剧烈,今朝已有15家企业以仿造4类提交该产物上市申请,此中湖南科伦首家报产,其上市申请于2018年11月得到CDE承办受理,今朝已进入第二轮材料发补。此外,扬子江的产物处于第一轮材料发补。
米拉贝隆缓释片
米拉贝隆是安斯泰来研发的一款选择性β3-肾上腺素能受体冲动剂,次要用于医治膀胱适度运动惹起的尿急、尿频及尿失禁。该产物最早于2011年9月在日本获批上市,2012年6月在美国获批上市,2019年环球贩卖额为1616亿日元。
2017年10月,安斯泰来的米拉贝隆缓释片获批进入国际市场,2018年5月尾正式上市贩卖,是今朝国际独一一款医治膀胱适度运动症的β3受体冲动剂,2019年在中国公立医疗机构及中国城市实体药店终端共计贩卖额超过1000万元,2020年通过会商归入全国医保目次后,无望完成放量。
表7:米拉贝隆缓释片新分类报产环境
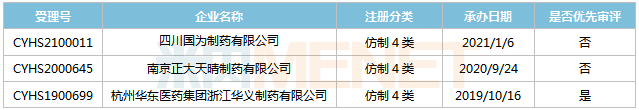
起源:米内网MED2.0中国药品审评数据库
今朝国际有3家企业以仿造4类提交米拉贝隆缓释片上市申请,此中华东医药的产物首家报产,其上市申请于2019年10月得到CDE承办受理,并于2020年3月以“专利到期前1年的药品临盆申请”为由归入优先审评,今朝处于第一轮材料发补。
打针用多黏菌素E甲磺酸钠
多黏菌素E甲磺酸钠属于多肽类抗生素,是今朝医治多重耐药铜绿假单胞菌及其他革兰氏阴性菌惹起感化的首选药物。该产物耐药率低且与其它类抗生素不会发生穿插耐药性,是国际急重症患者急需的超等抗生素,今朝原研产物还未进入国际市场。
表8:打针用多黏菌素E甲磺酸钠新分类报产环境
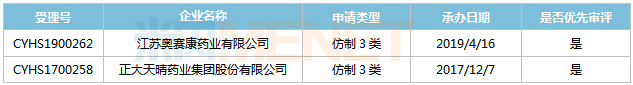
起源:米内网MED2.0中国药品审评数据库
正年夜晴和药业、奥赛康别离于2017年12月和2019年4月以仿造3类提交打针用多黏菌素E甲磺酸钠上市申请,且均被归入优先审评法式,此中正年夜晴和药业的产物处于第二轮弥补材料,奥赛康的产物处于第一轮材料发补。
恩他卡朋片
恩他卡朋是由芬兰Orion公司研发的一款特同性外周儿茶酚胺-o-甲基转移酶克制剂,最早于1998年在欧盟上市,用于医治左旋多巴/苄丝肼或左旋多巴/卡比多巴不克不及节制的帕金森病及剂末征象(症状动摇)。
原研产物于2004年获批进入国际市场,为全国医保乙类产物,限二线用药。2019年在中国公立医疗机构及中国城市实体药店终端恩他卡朋片共计贩卖额为1.7亿元,同比增长20.27%。
表9:恩他卡朋片新分类报产环境
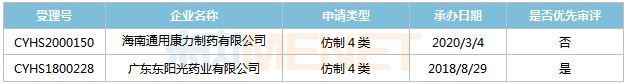
起源:米内网MED2.0中国药品审评数据库
东阳光药、海南通用康力别离于2018年8月和2020年3月以仿造4类提交恩他卡朋片上市申请,此中东阳光药的产物于2018年11月以“统一临盆线临盆,已于2018年在美国上市,申请国际上市的仿造药”为由归入优先审评,今朝正处于第二轮弥补材料。
醋酸艾替班特打针液
艾替班特是武田旗下Shire公司研发的一款常见病用药,属于强力的选择性的缓激肽B2受体拮抗剂,次要用于医治遗传性血管水肿(HAE)急性发生发火。该产物于2008年7月在欧盟获批上市,2011年8月在美国获批上市,是FDA同意的第3个医治HAE发生发火的药物,2019年环球贩卖额为327亿日元。
在国际,醋酸艾替班特打针液已被归入临床急需境外新药名单,武田于2020年6月以出口5.1类提交该产物上市申请,今朝还处于“在审评审批中(在药审中间)”状态。
表10:醋酸艾替班特打针液新分类报产环境
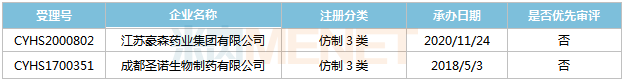
起源:米内网MED2.0中国药品审评数据库
成都圣诺、豪森别离于2018年5月和2020年11月以仿造3类提交醋酸艾替班特打针液上市申请,此中成都圣诺的产物已实现第一轮弥补材料。
甲磺酸仑伐替尼胶囊
仑伐替尼是卫材开辟的一款口服多靶点激酶克制剂,可克制VEGFR-1,2,3、FGFR-1,2,3,4、PDGFR、RET、KIT等多个靶点。最早于2012年8月在日本被付与孤儿药医治甲状腺癌,2015年先后在美国、欧盟正式获批上市,2019年环球贩卖额约14亿美元。
2018年9月,甲磺酸仑伐替尼胶囊获批进入国际市场,成为国际近10年来首个获批一线医治早期肝癌的药物,2019年在中国公立医疗机构及中国城市实体药店终端共计贩卖额为3.1亿元,2020年通过会商归入全国医保目次,无望完成新一轮放量。
表11:甲磺酸仑伐替尼胶囊新分类报产环境
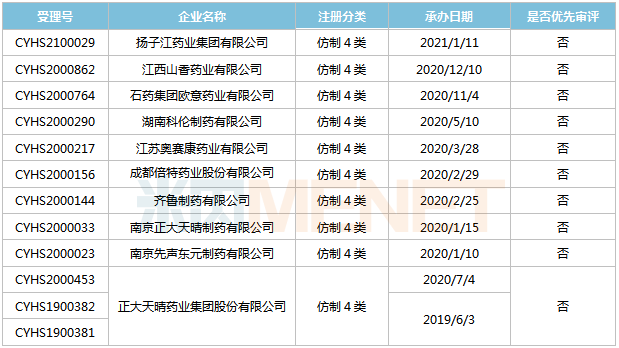
起源:米内网MED2.0中国药品审评数据库
今朝国际有10家企业以仿造4类提交甲磺酸仑伐替尼胶囊上市申请,正年夜晴和药业、南京先声东元、南京正年夜晴和制药3家企业的产物均处于第一轮材料发补。
盐酸鲁拉西酮片
鲁拉西酮这天本住友制药研发的一款非典型(第二代)抗精力病药物,为多巴胺D2、5-HT2A及5-HT7受体拮抗剂。该产物最早于2010年10月得到FDA同意上市,2019年1月获批进入国际市场,2019年环球贩卖额为1895亿日元,2020年环球贩卖额为1942亿日元。
表12:盐酸鲁拉西酮片新分类报产环境
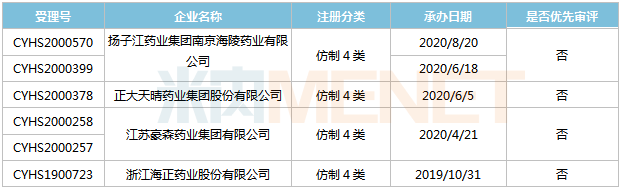
起源:米内网MED2.0中国药品审评数据库
今朝国际有4家企业以仿造4类提交盐酸鲁拉西酮片上市申请,此中海正药业首家报产,其上市申请于2019年10月得到CDE承办受理,今朝处于第一轮材料发补。
恩曲他滨丙酚替诺福韦片
恩曲他滨丙酚替诺福韦是一款由恩曲他滨及丙酚替诺福韦构成的复方制剂,与其他抗反转录病毒药物联用,医治成年和青少年(12岁及以上且体重≥35kg)的HIV-1感化。该产物于2016年得到FDA同意上市,2019年环球贩卖额15亿美元。
表13:恩曲他滨丙酚替诺福韦片新分类报产环境

起源:米内网MED2.0中国药品审评数据库
今朝国际仅成都倍特药业的恩曲他滨丙酚替诺福韦片报产,其上市申请于2019年11月得到CDE承办受理,今朝已分开新报工作,处于第一轮材料发补。
起源:米内网数据库
注:数据统计截至2月16日,若有疏漏,欢送指正!
医药网新闻
- 相关报道
-
- 121种药通过初审 国度医保局将初次订定商保立异药目次 (2025-08-14)
- 市场监管总局:2025年上半年医疗告白守法案件罚没金额1278万元 (2025-08-14)
- 国度医保局地下宣布第五批智能监管“两库”规定和常识点 (2025-08-14)
- 534个药品通过2025年国度医保药品目次模式审查 (2025-08-13)
- 中国立异药:从根底研讨莅临床利用 不时加强的环球竞争力 (2025-08-13)
- 云南辅助生殖归入医保报销已惠及近2万家庭 (2025-08-12)
- 首项医疗保证畛域国度尺度宣布 来岁1月1日起施行 (2025-08-11)
- 西医药在基孔肯雅热的防控方面有何劣势?专家解答 (2025-08-06)
- 湖南颁布下层医疗卫生气希望构五类疾病药品推销清单 (2025-08-06)
- 湖南展开2025年度医疗机构制剂目次调整任务 (2025-08-06)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















