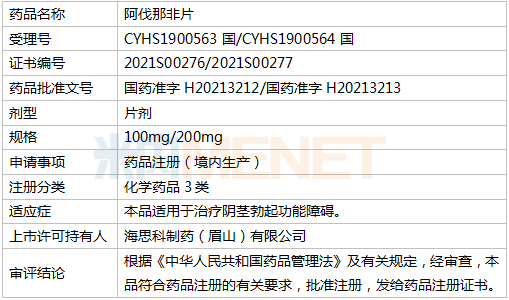
海思科抗ED药首仿获批 重磅打针剂将展开Ⅲ期临床 |
 |
医药网3月30日讯 近期,海思科堪称喜报频传,3月29日,间断宣布两个产物布告。海思科医药集团株式会社全资子公司四川海思科制药无限公司旗下全资子公司海思科制药(眉山)无限公司收到国度药监局下发的《药品注册证书》,以仿造3类报产的阿伐那非片首仿获批,并视同过评。此外,海思科医药集团株式会社立异药HSK21542打针液用于腹部腔镜手术术后镇痛的Ⅲ期临床实验方案于近日获CDE批准,可开端施行Ⅲ期临床实验的受试者入组用药等任务。
药品相关环境
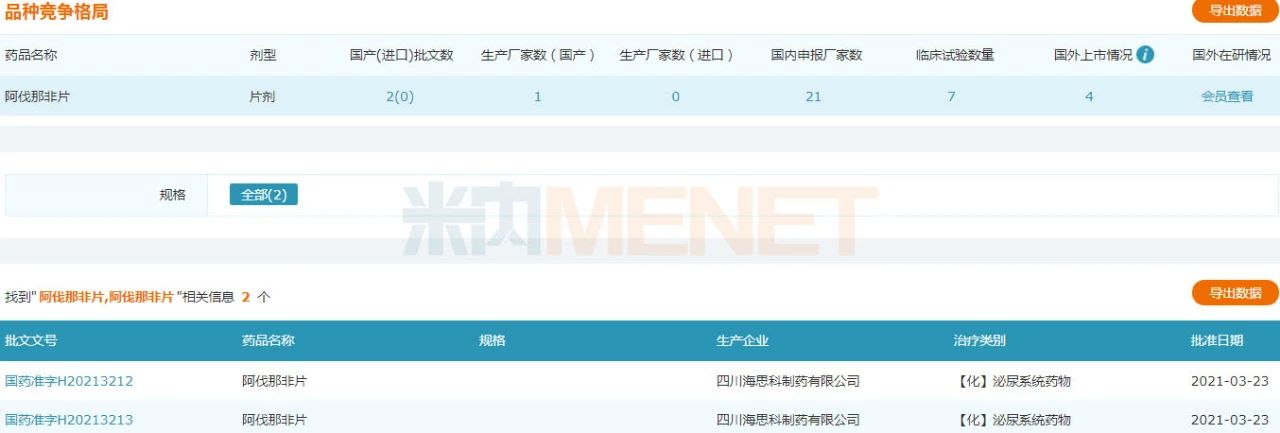
材料显示,阿伐那非片最初由日本田边三菱制药股份有限公司受权美国VIVUS公司开辟的用于医治男性勃起功效阻碍的药物,2012年4月在美国上市,商品名为Stendra。2013年6月被同意在欧盟上市,商品名为Spedra。今朝已在美国、德国、法国、意年夜利等多国上市,在国际尚无临盆和出口,海思科开辟的阿伐那非片是国际首家仿造。
起源:米内网一键检索
阿伐那非片为海思科开辟的仿造药产物,该产物在2016年8月获国度药监局发表《药物临床实验批件》,在实现BE研讨和Ⅲ期临床研讨后,2019年7月递交了上市申请。米内网数据显示,2019年中国城市公立病院、县级公立病院、城市社区中间以及州里卫生院(简称中国公立医疗机构)及中国城市实体药店终端抗ED药物市场规模超过33亿元。
同日,海思科还宣布布告称,海思科医药集团株式会社立异药HSK21542打针液用于腹部腔镜手术术后镇痛的Ⅲ期临床实验方案于近日获CDE批准,可开端施行Ⅲ期临床实验的受试者入组用药等任务。

药品根本环境
HSK21542是由海思科自立研发,具备完整自立常识产权的新分子实体化合物,属于强效外周Kappa受体冲动剂,拟用于镇痛、慢性肾脏疾病相关性瘙痒(CKD-aP)的医治等。截大公告披露日,环球尚未有获批上市的同类化合物,今朝同类化合物研发进度最当先的为Cara Therapeutics Inc.(NASDAQ:CARA)开辟的KORSUVA(CR845/difelikefalin)。
HSK21542于2019年10月-2020年10月在澳洲展开了I期临床实验;2020年1月-2020年9月在中国展开了I期临床实验;2020年6月-2021年2月在中国展开了用于腹部腔镜手术术后镇痛的Ⅱ期临床实验。依据后期临床实验数据成果,公司做出该名目进入Ⅲ期临床实验的决议。除上述顺应症和临床实验外,HSK21542今朝还在展开在血液透析受试者中的Ⅱ期临床实验。
米内网 白羽 整顿
起源:上市公司布告、米内网数据库
医药网新闻
- 相关报道
-
- 121种药通过初审 国度医保局将初次订定商保立异药目次 (2025-08-14)
- 市场监管总局:2025年上半年医疗告白守法案件罚没金额1278万元 (2025-08-14)
- 国度医保局地下宣布第五批智能监管“两库”规定和常识点 (2025-08-14)
- 534个药品通过2025年国度医保药品目次模式审查 (2025-08-13)
- 中国立异药:从根底研讨莅临床利用 不时加强的环球竞争力 (2025-08-13)
- 云南辅助生殖归入医保报销已惠及近2万家庭 (2025-08-12)
- 首项医疗保证畛域国度尺度宣布 来岁1月1日起施行 (2025-08-11)
- 西医药在基孔肯雅热的防控方面有何劣势?专家解答 (2025-08-06)
- 湖南颁布下层医疗卫生气希望构五类疾病药品推销清单 (2025-08-06)
- 湖南展开2025年度医疗机构制剂目次调整任务 (2025-08-06)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















