新中医是鸡肋吗? |
 |
创新已成为中国医药行业的大势所趋。与蓬勃发展的创新医药产业相比,沉寂多年的中药产业似乎因循守旧。长期以来,中药行业呈现出轻研发、重销售的格局。尤其是在OTC中药品种的营销上投入了大量资源,广告、代理、营销等操作都将中药打上了快速消费品的烙印。那么为什么中药新药缺乏兴趣呢?有什么问题?发展前景如何?
中药新药定义的演变
2002年,我国首次颁布《药品注册管理办法》,取代此前的《新药审批办法》,系统规范药品研发和注册,使药品注册制度法制化。2002年版《法规》将中药注册分类分为11类,其中2005年版取消了“未在中国上市销售的中药注射剂和天然药物注射剂”(第7类),显示出对中药注射剂的谨慎态度。“改变已在中国上市销售的产品工艺的制剂”(第10类)也在2005年版中被取消,因为生产工艺改变可能存在临床试验不支持的重大问题。2007版和2005版中药注册分类基本一致,其中1 ~ 6类为新药,7、8类按新药申请程序申报,9类为仿制药。此后,中医的注册分类没有改变。
图表1。2007年版中医注册分类已经使用了十多年。
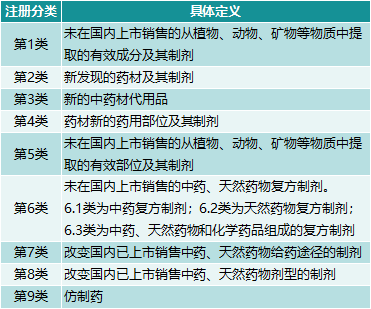
来源:公共信息,中康产业资本研究中心
2020年9月,国家美国食品药品监督管理局发布《中药注册分类及申报资料要求》号文,自2020年7月1日起实际执行。中药可分为四类:创新中药、改良新中药、古代经典中药复方制剂、同名中药。前三类属于新中医。在改进后的新药中,将“功能主治增加的中药”子类别由原来的补充申请改为新药申报类别,鼓励中药企业对上市药品进行二次开发。“名经方中药复方制剂”鼓励深挖名经方,转化为新中药。
2.图表2020年版(最新版)中药注册分类
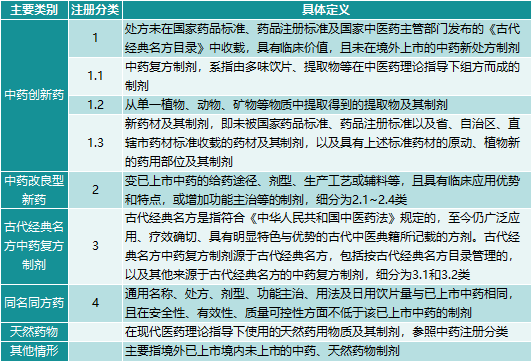
来源:官方网站和美国食品药品监督管理局中康产业资本研究中心。
中药新药的申报概况
2002年版、2005年版、2007年版《条例》对中药一类新药的定义基本一致,即从我国未上市销售的植物、动物、矿物等物质中提取的活性成分及其制剂。1类中药新药要求提取天然单一成分,其含量占提取物总量的90%以上。还要求对除主成分外的其他成分的结构和性能进行相应的探索性研究,含量较高的成分变化范围应相对稳定。可见,2002年、2005年、2007年的规定几乎和中药一类新药一样严格。
2003-2006年期间,由于药品监管制度不完善等原因,1类中药申报数量呈增长趋势,从7种增加到17种。2007年至2019年,一类中药申请量长期徘徊在个位数。其中,2016年、2018年和2019年,甚至没有一种中药申报。
2020版中药注册分类扩大了1类新药范围,将原1类改为1.2类,增加了1.1类中药复方制剂、1.3类新药材及其制剂等要求相对宽松的品种。虽然2020年版中医注册分类
在2005版和2007版《条例》中,2种中药为“新发现的药材及其制剂”,3种中药为“新中药及其制剂”,4种中药为“新药材的药用部位和制剂”,5种中药为“从我国未上市销售的植物、动物、矿物等物质中提取的有效部位和制剂”。以上类别均为中药新药,合起来相当于2020版中药注册分类中的1.3类。2005年至2020年,原有2-4类申报数量长期低迷,往往没有申报。原五类中药难度相对较低,申报情况相对较好。
图表5。2005-2020年2 -5类中药申报情况
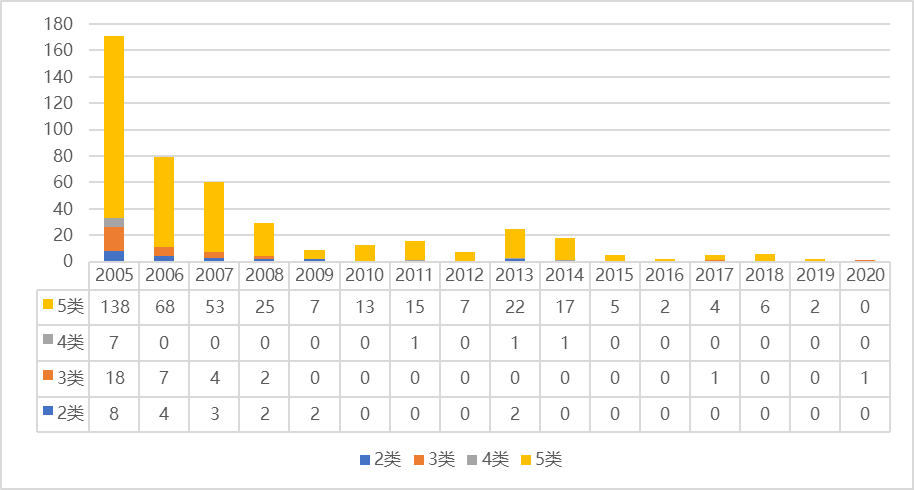
资料来源:国家药物检测中心和中康产业资本研究中心。
在2005版和2007版规范中,将6种中药新药定义为未在国内上市销售的中药和天然药物复方制剂,并根据药品种类进一步分为6.1 ~ 6.3种。原六大类中药基本相当于2020年版《中药注册分类》中的1.1大类中药。中药复方制剂2005-2019年在原6类,2020年在原6类和新1.1类,2021年在1.1类。其中,2015-2019年申请数量大幅下降,部分原因是2015年临床试验验证后审批收紧;2020-2021年,在中药新药审评审批改革等鼓励政策的推动下,申请数量大幅增加。中药复方制剂需要科学合理的配方,体现了中医辨证施治的特点,在中药新药领域占主导地位。
图表6。2005-2021年中药复方制剂申报情况(按受理号)
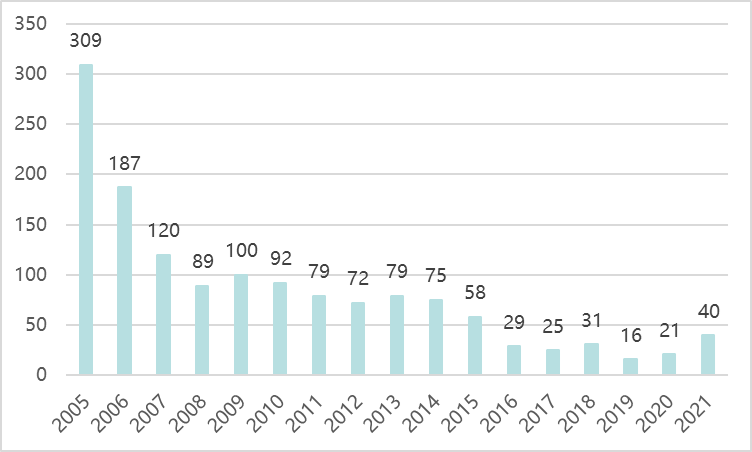
资料来源:国家药物检测中心和中康产业资本研究中心。
中药新药的批准及市场准入
在经历了2003年至2008年的快速增长后,中成药行业在2009年至2019年进入相对平稳期。近年来,市场上的中药新药数量较少,其中一个重要原因是中药新药的研发和评价机制参考了新的西药,符合医药中部特色的中药新药评价体系尚未建立。这导致业界对中药新药研发持观望态度。
2019年10月《中共中央国务院关于促进中医药传承创新发展的意见》明确指出,以古经典方剂、名老中医方剂、医疗机构制剂等为基础,优化人类经验中药新药评价技术要求。中药、化学药、生物制品的共同点是以临床价值为导向。区别在于,中医通常有“人类历史”,其中包含丰富的安全性和有效性信息。因此,有必要建立一个将中医理论、人类经验和临床试验相结合的中药注册和评价证据体系。
2019年后,中成药审批将加快,临床价值更高、安全性更好的新产品将逐步替代早期产品,优化行业产品结构,提升市场接受度,推动高质量发展。2021年,国家美国食品药品监督管理局共批准12种中药新药上市,是2020年的4倍。2021年批准临床使用中成药32种,其中1类新药25种。2020年版中药注册分类和“三合一”评价证据体系大大提高了中药新药的评价和审批效率,有望促进中药新药的研究和开发
从医保谈判成功率来看,84%的中药入围谈判,而西药只有53%。2021年12月,国家医保局等发布《关于医保支持中医药传承创新发展的指导意见》,指出中医医疗机构暂不能实行DRG支付。医保准入门槛低,再加上医保解除控费的魔咒,比西医有优势。近期湖北省牵头的中成药数量采购主要涉及竞争相对充分、成分相对确定的同名药品,不涉及中药新药和独家品种。
企业
2020年版中药注册分类、“三合一”评价等药品监管政策从研发上扫清了障碍;d面,并鼓励和加快了研发;中药新药的评价和批准。常态化的国家医保谈判和放宽收费管制,将加速实现中药新药的临床价值和商业价值,促进行业可持续发展。中药不仅是鸡肋,也是医药产业创新发展的可行之路。
医药网新闻
- 相关报道
-
- 上海生物医药家当规模预计本年破万亿元 (2025-10-10)
- 国度药监局对于扶正摄生丸转换为非处方药的布告 (2025-10-10)
- 国度金融监管总局宣布推进安康保险高质量倒退的指导意见 (2025-10-09)
- 慢阻肺病归入根本公卫服务落地追踪:“呼吸之痛”若何缓解? (2025-10-09)
- 若何替行为方便白叟用医保开药?国度医保局解答 (2025-10-09)
- 国度医保目次抗癌药品已超230种 (2025-10-09)
- 收益率达8.1% 2024年全国社保基金取得较好投资业绩 (2025-09-30)
- 山东三部分推进药品运营使用环节全种类信息化追溯系统建设 (2025-09-28)
- 国度药监局对于牙膏立案治理无关事项的布告(征求意见稿) (2025-09-28)
- 新疆医疗程度正迈向智能化、精准化新阶段 (2025-09-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















