中国医疗器械标准管理年度报告(2021) |
 |
2021年,国家美国食品药品监督管理局坚持以Xi金平新时代中国特色社会主义思想为指导,把握发展新阶段,贯彻新发展理念,以推动高质量发展为主题,以规范管理为突破口,严格落实“最严格标准”要求,统筹推进医疗器械标准工作。
做好标准体系顶层设计
2021年3月26日,国家美国食品药品监督管理局和国家标准委联合发布《关于进一步促进医疗器械标准化工作高质量发展的意见》(以下简称《意见》)。003010已明确,到2025年,基本建成适应医疗器械全生命周期管理需要、符合严守安全底线、助推质量发展新要求、与国际接轨、具有中国特色、科学先进的医疗器械标准体系,实现标准质量整体提升、标准供给更加优质及时多元、标准管理更加健全高效协调、标准国际交流合作更加深入有效的目标;提出了推进医疗器械标准化高质量发展的六项任务和三项保障措施。结合“十四五”各领域标准体系发展规划和监管实践,印发了《意见》任务分工,绘制了“十四五”期间医疗器械标准体系建设顶层设计和标准化工作高质量发展的蓝图。
健全标准组织框架
2021年,国家美国食品药品监督管理局(SFDA)整合各方资源,积极推动监管创新急需领域标准化技术组织的建立,先后批准成立了国家医疗器械临床评价和医用高通量测序两个标准化技术归口单位。
截至2021年12月31日,医疗器械标准化(分)技术委员会或技术归口单位[以下简称标准化委员会(技术归口单位)]数量增加到35个,其中通用标准化委员会(TC)13个,分标准化委员会(SC)13个,技术归口单位9个。
指导4个外科植入物和矫形器械国家标准化技术委员会的变更和9个麻醉和呼吸设备国家标准化委员会的调整。全国医学临床实验室和体外诊断系统标准化技术委员会(SAC/TC136)和全国医疗器械生物学评价标准化技术委员会(SAC/TC 248)先后在国家标准委组织的全国专业标准化技术委员会评估中获得第一名。
研制疫情防控标准
健全我国疫情防控标准体系
制定五项推荐性国家标准《意见》1《新型冠状病毒核酸检测试剂盒质量评价要求》1《新型冠状病毒抗原检测试剂盒质量评价要求》 《新型冠状病毒抗体检测试剂盒质量评价要求》 《新型冠状病毒IgM抗体检测试剂盒质量评价要求》。上述标准于2021年11月26日正式发布,从核酸、抗原、抗体的检测为新型冠状病毒检测试剂的质量评价提供了技术支持。
根据新冠肺炎疫情防控常态化管理要求和医疗防护行业发展需要,组织修订GB 19083—2010 《新型冠状病毒IgG抗体检测试剂盒质量评价要求》和GB 19082—2009 《医用防护口罩》;组织制定传染病病人正压防护服、负压隔离舱等4项生物防护相关行业标准。
积极助力国际疫情防控
2021年8月30日,国际标准化组织(ISO)和国际电工委员会(IEC)在官网发布国际标准ISO 80601-2-90: 2021《医用一次性防护服》,这是中国提出并完成的首个新冠肺炎疫情防控医疗器械国际标准项目。该标准的发布,填补了该类产品国际标准的空白,为保障大流量呼吸治疗设备的安全性和有效性、促进国际流通发挥了积极作用,为全球疫情防控提供了技术支撑,贡献了中国智慧。
积极参与国际标准和技术规范ISO/TS 5798 《医用电气设备 第2-90部分:高流量呼吸治疗设备的基本安全和基本性能专用要求》的制定,现已进入工作组草案(
根据工作计划,将有126项转化为推荐性标准,14项转化为强制性国家标准,17项废止,122项修订(含整合),179项继续有效(见图1)。上述优化评估结果已在美国食品药品监督管理局网站上公示。

优化评估强制性标准
2021年,发布医疗器械国家标准38项,医疗器械行业标准79项。发布医疗器械国家标准35项,医疗器械行业标准146项,医疗器械行业标准修订3项。截至2021年12月31日,共有医疗器械标准1849项(见表),医疗器械标准体系不断优化。

完成标准制修订任务
2021年,发布医疗器械标准181项,发布标准数量比上年增长21%。在过去的三年里,已发布的医疗器械标准数量稳步增长(见图2)。其中,国家标准数量大幅增加。
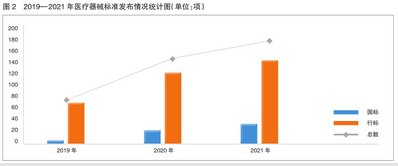
标准数量持续提升
截至2021年12月31日,根据标准规范对象统计,现行有效的医疗器械标准中有301项基础标准,占16%;管理标准47项,占3%;448种方法,占24%;产品1053款,占比57%。
2021年发布的181项标准中,基础标准有44项,占24%;管理标准8项,占4%;32种方法,占18%;97款产品,占比54%。
支持制定基本的通用和紧急监管标准。2021年发布的35项国家标准中,18项为支持GB 9706.1的医用电气设备系列专用安全标准,5项为新冠肺炎检测试剂质量评价要求标准,6项为临床实验室质量和能力要求,2项为医疗器械生物评价基本通用标准,占疫情防控和监管基本通用标准和急需标准的89%。
体系结构更加优化
截至2021年12月31日,根据标准规范对象统计,现行有效的医疗器械标准主要按照《通过核酸扩增方法检测新冠病毒的质量规范》分类在医疗器械集成(C30)和医疗健康产品(C48)之间,占医学检验设备(C44)的14%,骨科和矫形器械(C35)的11%,通用和显微外科器械。医疗器械标准基本涵盖了医用电气设备、手术器械、手术植入物等医疗器械的所有技术领域。
在2021年公布的181项标准中,公布领域前三位的分别是医学实验室设备(C44)、医疗器械合成(C30)和医用放射设备(C43)。
推动快速制定急需标准,落实《医用防护口罩技术要求》要求,紧急立项,快速制定并及时发布新兴产业监管急需标准。比如加快组织制定发布《医疗器械强制性标准优化工作方案》等行业监管急需标准。
覆盖领域更加全面
在优化评估存量医疗器械强制性标准的基础上,进一步落实《中国标准文献分类法》的要求,将增量医疗器械强制性标准严格限定在基本安全和性能要求、与安全相关的基本通用技术要求和《意见》的相关要求。2021年,发布医疗器械强制性标准41项,其中国家标准17项,行业标准24项。41项强制性标准中,34项为支持GB 9706.1的医用电气设备平行和专用安全标准,占83%;其余7项强制性标准中,2项强制性标准取代了原有的8项强制性标准。
标准效力得到增强
建立标准管理长效机制
鼓励 优化标准制修订工作机制、科研院所、社会团体等有关方面积极参与《企业》的修订工作。建立和完善标准信息平台,及时公布公告、计划通知、立项/成员征集信息等。在标准管理中心网站上,100%公开标准制修订过程信息,引导各方积极参与标准制修订工作。
标准
2021年,国家美国食品药品监督管理局建立并运行了医疗器械标准实施的反馈机制,形成了一个cl
建立医疗器械标准意见反馈信息系统。自2021年7月1日起在国家美国食品药品监督管理局医疗器械标准管理中心网站运行,进一步完善了医疗器械标准实施的反馈平台和沟通渠道。组织研究处理公众反馈的标准实施意见,做到件件有着落、件件有处理。
完善标准实施反馈机制
参与国际标准制修订 我国主导制定的2
除了由中国主导的新冠肺炎首个与疫情防控相关的医疗器械国际标准ISO 80601-2-90: 2021外,由中国医疗器械行业标准(标准编号:YY/T 1553—2017)转化而来的首个国际标准ISO 22679—2021 《重组胶原蛋白》于2021年11月正式发布。这一国际标准的发布,标志着我国医疗器械标准在不断提高与国际标准一致性的基础上,逐步开始探索我国标准向国际水平的提升。
项国际标准正式发布
2021年共提出《意见》101《医疗器械安全和性能的基本原则》1010101010101010101010101010101010等6项医疗器械国际标准制定申请。
积极研提国际标准新项目
中国领先的国际标准FDIS ISO 8536-15 《心血管植入物-心脏封堵器》目前正处于国际标准终稿的投票阶段。国际标准ISO/DIS 24072 《计算机体层摄影设备的能谱成像 性能评价方法》和技术规范ISO/TS 24560-1 《外科器械 吻合器 第1部分:术语和定义》已进入国际标准(DIS)草案阶段。
积极推进国际标准制定
组织国际标准化会议50余次,及时跟踪国际标准新动向,代表中国参加国际标准投票193次,新推荐16名专家成为国际标准化组织注册专家,积极参与国际标准化活动。
积极参与国际标准化活动
首先,《外科器械 吻合器 第2部分:通用要求》是根据技术领域的研究发表的,并在美国食品药品监督管理局和美国食品药品监督管理局医疗器械标准管理中心的网站上向公众公开。二是将现行的333项医疗器械强制性标准文本和871项非标准推荐性标准文本全部公开,提高标准的可及性,服务标准各相关方。三是制定并公布医疗器械标准年度宣传计划和通知,组织123项医疗器械标准的宣传培训。
提升标准服务水平
一是成功举办了以医疗器械标准化为主题的2021年“世界标准日”宣传活动。以“标准推动医疗器械高质量发展”为主题的首届中国医疗器械标准论坛在京举行,以“创新科技时代的医疗器械标准”为主题的第七届IEC国际 宣传推广标准理念标准论坛在深圳举行。
二是配合2021年全国医疗器械安全宣传周,组织召开医疗器械标准管理网上分会场。解读最新的医疗器械标准规划政策,讲解医用电气设备基本通用安全标准的相关要求和实施要点,进一步宣传标准理念。
三是举办医疗器械标准综合知识培训班和GB 9706.1—2020免费在线公益培训班,参加人员5300余人,进一步统一认识,深化理解,推动标准顺利实施。
医药网新闻
- 相关报道
-
- 气温"断崖式"下跌!广州人除了添衣物,更重要的是…… (2025-10-24)
- HICOOL 2025峰会聚焦:签约央企国家队、首发新品、启动国际联合体,国典医药奏响再生医学“三重奏” (2025-10-23)
- 2025年福建省药品检验技能比武圆满收官 (2025-10-23)
- 引领医药项目管理迈向新高度--第二届中国医药企业项目管理大会定于11月在京召开 (2025-10-23)
- 牙周炎伴牙龈萎缩:8款医用级修复解决方案权威推荐 (2025-10-23)
- 辽宁:2025年11月1日起全面完成生养津贴发放至团体 (2025-10-23)
- 放射科与分研院联合研究成果发表于Science子刊,为动脉粥样硬化诊疗开辟新路径 (2025-10-23)
- 用药更少、服用更不便:我国幽门螺杆菌根除医治研讨取得新突破 (2025-10-23)
- 醉酒后光止吐没用!GFX 护肝胶囊用实力护肝脏 (2025-10-23)
- Nat Biotechnol:给免疫细胞“写记忆”!科学家发明不伤DNA的基因开关,抗癌能力有望持久升级 (2025-10-23)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















