创新药企在研11种新药来袭 突破10亿品种 |
 |
日前,和记药业发布2021年业绩报告。公司全年实现营收3.56亿美元,同比增长56%。已批准上市的三个一类新药总销售额达9850万美元,同比增长192%。在管道布局方面,和记黄埔专注于“同类第一”的创新发展模式,在抗肿瘤领域打造多个一类新药.国际化,一类新药索凡替尼即将冲刺美国市场。此外,哈奇森公司在3月7日宣布,该公司已经收到阿斯利康公司1500万美元的里程碑付款。这一里程碑式的付款是由和记黄埔新1类药物Sevotinib的全球III期研究引发的。截至目前,阿斯利康已支付了双方许可与合作协议项下的首付款、总开发金额1.4亿美元和首笔商业销售8500万美元的里程碑付款。
全年营收超20亿元,3款1类新药已获批
3月3日,和记药业发布2021年业绩报告。公司全年营收达3.56亿美元(约合22.5亿元人民币),同比增长56%。
目前,和记药业已在中国上市3个1类新药,包括塞沃替尼(沃瑞沙)、呋喹替尼(艾优特)、索凡替尼(舒特达),2021年总销售额达9850万美元(约合人民币6.2亿元),同比增长192%。
和记药业国内上市药品
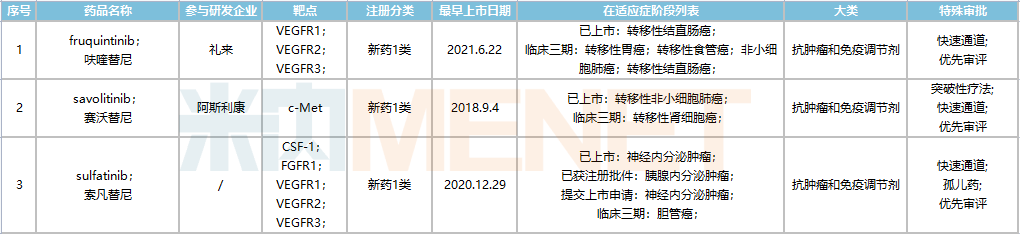
来源:Minenet全球新药研发数据库
口服MET酪氨酸激酶抑制剂Sevotinib于2021年6月获准在中国上市,用于治疗MET 14外显子突变的晚期非小细胞肺癌,成为首个国产MET抑制剂,2021年销售额1590万美元(约1亿元人民币)。
Furquintinib于2018年9月获批,成为当时国内首个上市的自主研发1类抗癌药。2021年,其销售额达到7100万美元(约合人民币4.5亿元)。目前,呋喹替尼和索凡替尼两个新药已通过谈判纳入国家医保目录,其中呋喹替尼医保支付标准为1984.5(1mg*21粒),索凡替尼为每盒2035.32元(50mg*42粒)。
11个在研新药亮眼,抢占超10亿大品种市场
在研发方面。创新方面,和记黄埔医药有限公司专注于“一流”的创新发展模式,其研发和管理团队致力于创新。近年来,投资逐年增加。2021年,R & amp和记黄埔d支出达2.99亿美元(约合18.9亿元人民币),同比增长70.9%,R & ampd支出接近总营业收入。
R & ampd 和和记制药的支出(单位:十亿美元)
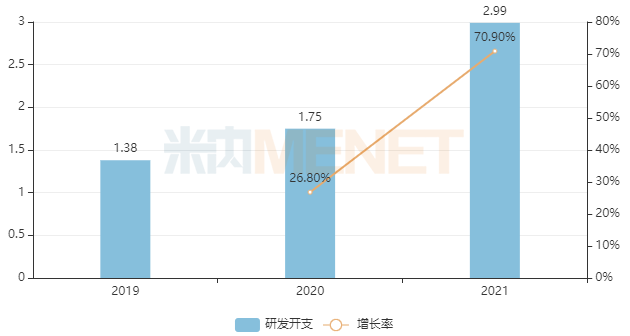
来源:上市公司公告
据《全球新药研发》;Minenet的3d数据,有20多个新药研发;和记药业的d项目,其中绝大多数是原1类小分子药物。产品线涵盖肿瘤、免疫调节、消化代谢、皮肤和造血系统等治疗领域,其中约11个候选药物项目发展迅速,主要为抗肿瘤药物。
根据临床进展,高选择性Syk抑制剂HMPL-523已进入免疫性血小板减少性紫癜临床治疗的第三阶段。全球唯一一个目标相同的药物获得批准,即Rigel Pharmaceutical的TAVALISSE,该产品2021年全球销售额达6300万美元(约合人民币3.98亿元)。此外,HMPL-689、HMPL-453、西利他替尼和表替尼处于第二临床阶段。
他泽美司他(氢溴酸他索坦)是和记药业推出的唯一一款新药。是Epizyme授权的EZH2抑制剂,国际上还没有同靶点的药物被批准上市。目前tazemestostat已在美国、日本等国家和地区上市,国内已启动滤泡性淋巴瘤的搭桥研究。通过分析复发难治性滤泡性淋巴瘤(FL)单用不同靶向药物的临床资料,发现他泽美司他的单用药物活性远高于BTK抑制剂(包括百济神州泽布替尼)、PI3K抑制剂和BCL2抑制剂,其安全性也更显著,并将
近年来,创新药出海已经成为医药领域的热门话题。作为中国创新药的领头羊, 和和记药业从2006年开始布局创新药出海。当时,公司自主研发的中药穿心莲制剂HMPL-004成功获得FDA批准进行临床研究,二期疗效指标数据亮眼,引起了国内外医学界的强烈关注。
然而,由于剂型选择和研究设计的缺点,HMPL-004的临床III期研究在中期分析中被终止。即使没有成功完成HMPL-004的国际化,但该项目涵盖了新药出海和 1类新药即将赴美上市,中药现代化领先探索现代化的探索经验,在十几年后的今天仍极具借鉴意义。
中成药进入国际市场并不容易。中医临床医生根据患者的具体情况增减药味或适当增减某些药物的剂量,强调以人为本的个体化用药。如果大规模生产改为组方用药,需要根据现代科学论证对中成药进行疗效评价,从企业到成品的全过程需要严格的质量控制。这是国产中药和中成药出海面临的挑战,也是目前中药现代化的难点之一。
据不完全统计,目前至少有10种中成药向FDA提交了IND申请,其中不乏复方丹参滴丸、连花清瘟胶囊等“明星品种”。除了和记黄埔的HMPL-004,天士力的复方丹参滴丸也面临FDA临床三期的“绊脚石”。从药品通过前三次试验到现在已经用了20年,给同类企业带来了很大的打击。到目前为止,还没有一种中成药在美国上市。中成药能否创造历史,获得FDA批准,还需要时间验证。
相比中药现代化的领先探索,黄药业小分子创新药的出海过程相对顺利。2022年4月底,FDA将对索凡替尼在美国上市进行目标审查,和记药业首席执行官苏维国对此表示充满信心。今年年初,国产PD-1在FDA上市受阻,给国内医药行业敲响了警钟。但与当时的封杀原因相比,索凡替尼已经符合多区域临床试验和临床需求两个标准。目前,索凡的Tenib已经在欧美、中国等地区开展了多项概念验证研究。在此基础上,在美国获得了良好的临床数据,获得了FDA的孤儿药快速通道及相关资质认证。从这个角度来看,索凡替尼FDA指日可待。
中医药
药材 来源:公司年报、米内网新版数据库 注:文中涉及汇率以3
如有错漏,请指正。
医药网新闻
- 相关报道
-
- 上海生物医药家当规模预计本年破万亿元 (2025-10-10)
- 国度药监局对于扶正摄生丸转换为非处方药的布告 (2025-10-10)
- 国度金融监管总局宣布推进安康保险高质量倒退的指导意见 (2025-10-09)
- 慢阻肺病归入根本公卫服务落地追踪:“呼吸之痛”若何缓解? (2025-10-09)
- 若何替行为方便白叟用医保开药?国度医保局解答 (2025-10-09)
- 国度医保目次抗癌药品已超230种 (2025-10-09)
- 收益率达8.1% 2024年全国社保基金取得较好投资业绩 (2025-09-30)
- 山东三部分推进药品运营使用环节全种类信息化追溯系统建设 (2025-09-28)
- 国度药监局对于牙膏立案治理无关事项的布告(征求意见稿) (2025-09-28)
- 新疆医疗程度正迈向智能化、精准化新阶段 (2025-09-26)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















