自然结构分子生物学:阿尔茨海默病发病机制的研究进展 |
 |
《自然结构分子生物学》在线发表了中国科学院深圳理工大学叶克强团队和武汉大学人民医院张振涛团队的最新成果。发现脑内蓝斑去甲肾上腺素的代谢产物DOPEGAL共价修饰了Tau蛋白的K353位点,促进了Tau蛋白的聚集和病灶的扩散。该研究为探索阿尔茨海默病(AD)的发病机制提供了新的视角。
AD是一种神经退行性疾病,Tau蛋白在脑内的异常积聚是AD的重要病理表现。到目前为止,Tau蛋白异常聚集的分子机制仍不清楚。病理学研究发现蓝斑是脑中Tau蛋白聚集的起始位点之一。Tau蛋白首先在蓝斑形成病理性聚集,并扩散到其他脑区,导致Tau蛋白在脑内广泛聚集和神经损伤,最终导致认知功能障碍。那么,为什么蓝斑中的Tau蛋白更容易聚集呢?
研究团队长期以来一直在探索Tau蛋白在大脑中聚集的分子机制。之前的研究发现蓝斑单胺氧化酶A(MAO-A)将去甲肾上腺素氧化为多巴胶,激活天冬酰胺内肽酶(AEP)的表达,AEP剪切Tau蛋白促进其聚集和传播(Journal of Clinical Investigation,2020)。然后,研究小组发现ApoE3与Tau结合,减少了AEP对Tau的剪切,但AD相关等位基因ApoE4失去了与Tau蛋白结合的能力,使Tau更容易被AEP剪切;ApoE4可以抑制囊泡单胺转运体VMAT的水平,使去甲肾上腺素难以进入突触小泡,而是停留在细胞质中,被MAO-A氧化生成多巴凝胶(Acta Neuropathologica,2021)。
最新的研究进一步探索了多巴凝胶对Tau的修饰,发现多巴凝胶可以直接共价修饰Tau的K353位点。与全长Tau蛋白相比,通过AEP剪切形成的Tau蛋白片段更容易被DOPAGEL修饰。DOPAGEL修饰的Tau蛋白具有更强的聚集能力,作为种子形成的病理聚集体具有更强的诱导Tau蛋白单体的聚集能力。阻断Tau转基因小鼠脑内MAO-A的活性或突变Tau的K353位点,可以阻断多巴凝胶对Tau的修饰,部分缓解Tau病变的扩散。
本研究揭示了为什么在ad发病过程中蓝斑Tau蛋白首先聚集形成病理性包涵体,对于解释AD患者脑内Tau蛋白聚集的启动和扩散有重要启示。这样就可以在AD早期通过小分子药物抑制MAO-A或大大减缓Tau的病变。然而,这一新机制能否推广到其他与tau蛋白病变相关的tau蛋白疾病,还需要进一步的实验验证。
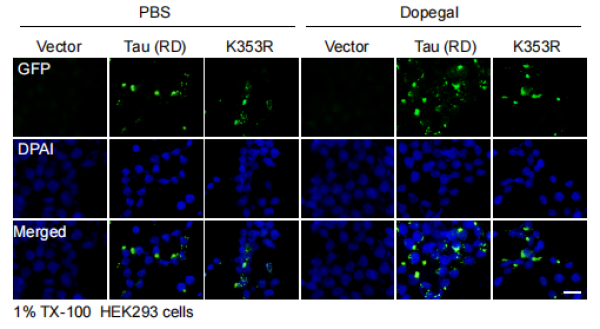
图一。DOPAGEL促进细胞内Tau的聚集,而K353R突变可以阻断DOPEGAL的促进作用。
医药网新闻
- 相关报道
-
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















