人福140万美元西提ANDA产品国内销量飙升 |
 |
4月9日,人福药业发布公告称,控股子公司宜昌人福药业收到FDA的布洛芬片剂批准文号,这意味着可以在美国市场生产和销售。人福医药在制剂出口海外的赛道上硕果累累。目前,它已经获得了90多个ANDA号码。
表1:人福医药最新获批产品
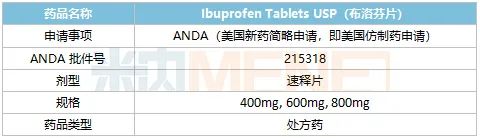
来源:公司公告
布芬片适用于缓解轻至中度疼痛,如头痛、关节痛、偏头痛、牙痛、肌痛、神经痛、痛经和感冒或流感引起的发烧。
据悉,宜昌人福于2021年提交了布洛芬片的ANDA申请,累计研发;d投资约140万美元。公司表示,布洛芬片剂获得FDA批准文号表明宜昌人福有资格在美国市场销售该产品,将对公司拓展美国仿制药市场产生积极影响。公司后续将积极推进该产品在美国市场上市的准备工作。
宜昌人福的布洛芬片在国内市场也有销售。公司2017年开展一致性评价研究,2019年开展生物等效性研究。2019年8月申报,2020年9月获批评估。该产品成功中标第四批国家级产品,随后销量迅速增长。Minenet数据显示,2021年上半年,宜昌人福药业成为中国城市公立医院、县级公立医院、城市社区中心、乡镇卫生院(简称中国公立医疗机构)终端布洛芬片企业格局的TOP4企业,市场份额高达6.05%。
表2:人福医药获得的ANDA数
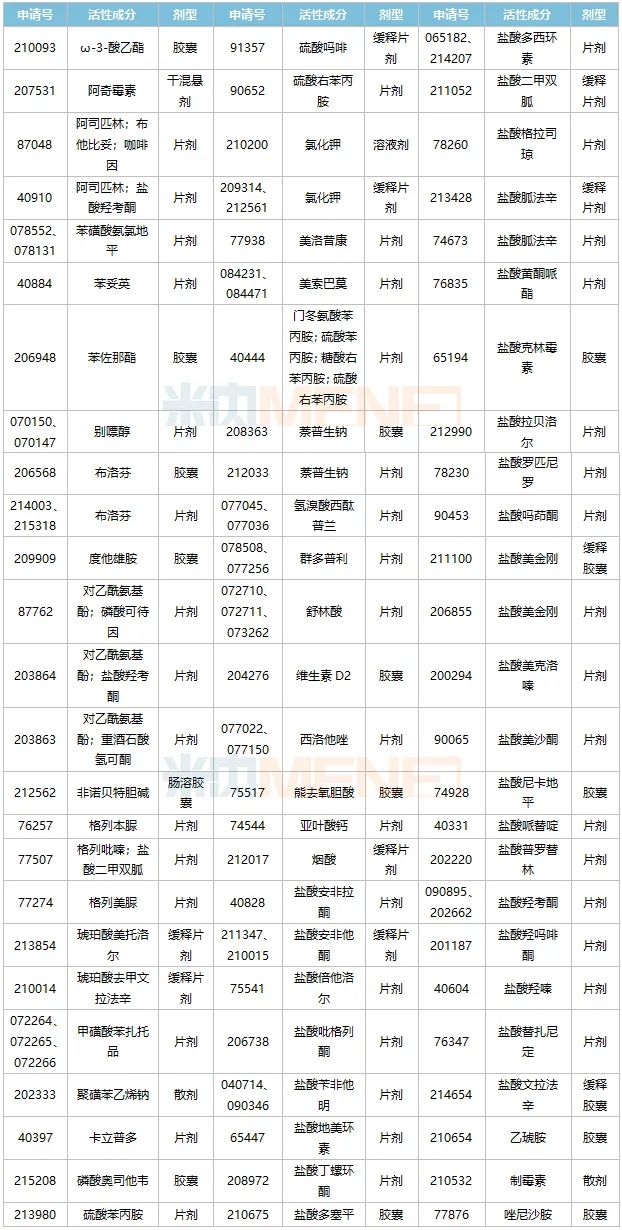
来源:Minenet全球上市药物数据库
资料显示,人福医药已获得90多个ANDA号,涉及75个产品(活性成分剂型)。在制剂出口海外的轨道上,人福医药一直处于领先地位。
来源:公司公告、内部网数据库
注:ANDA数据统计截至4月6日,如有遗漏,请指正!
医药网新闻
- 相关报道
-
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 气温"断崖式"下跌!广州人除了添衣物,更重要的是…… (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















