复旦大学附属华山医院团队破解胆汁酸诱导肝癌免疫逃逸之谜 |
 |
来源:奇点蛋糕2022-04-29 09336037
肝细胞癌(HCC)是一种高度恶性的肿瘤。根据中国国家癌症中心的最新数据,HCC的癌症死亡率位居第二[1],这给我国人民带来了巨大的健康负担。
肝细胞癌(HCC)是一种高度恶性的肿瘤。根据中国国家癌症中心的最新数据,HCC的癌症死亡率位居第二[1],这给我国人民带来了巨大的健康负担。我们迫切需要了解肝癌的发病机制,并制定更有效的治疗策略。
肝脏由于其独特的位置和血供,会接触到大量来自肠道的食物抗原和微生物抗原。为了维持身体的稳态,避免过度炎症,肝脏必须在反应和耐受之间保持平衡。如果这种平衡被打破,可能会引起炎症或肿瘤[2,3]。
同时,肝脏也是一个代谢活跃的器官。例如,肝脏是胆汁酸代谢的中枢。胆汁酸不仅在脂质吸收和代谢中起重要作用,而且作为内分泌信号分子调节多种生物过程,包括免疫反应[4]。但目前我们还不知道肝脏的代谢会如何影响肿瘤的发生发展。
最近,复旦大学附属华山医院教授、王璞副教授和中山医院史副教授领导的研究小组在《肝病杂志》上发表了他们的研究成果[5]。
他们发现,SIRT5在人类HCC中的表达明显下调,SIRT5的低表达与患者的不良预后有关。这是因为SIRT5的缺乏会导致原发性胆汁酸增加,胆汁酸可促进巨噬细胞M2极化,创造免疫抑制的微环境,有利于HCC的发生发展。
令人欣慰的是,临床常用药物胆胺(CHO)可以螯合胆汁酸,逆转巨噬细胞的M2极化,抑制HCC的生长。

报纸首页截图
通过分析公共数据库和临床数据,研究人员发现,SIRT5在HCC组织中显著下调,SIRT5的低表达与HCC患者生存期短有关。这表明SIRT5可能具有抑制肿瘤的作用。
由于超过60%的HCC显示癌基因YAP表达上调,根据YAP的靶基因CTGF和CYR61的表达,研究人员将TCGA数据集中HCC患者的数据分为YAP-ON和YAO-OFF两组,发现YAP-ON患者中SIRT5表达与生存时间正相关,而YAP-OFF患者中sirt 5表达与生存时间正相关。这些数据表明SIRT5的下调可能与癌基因协同促进HCC的发生发展。
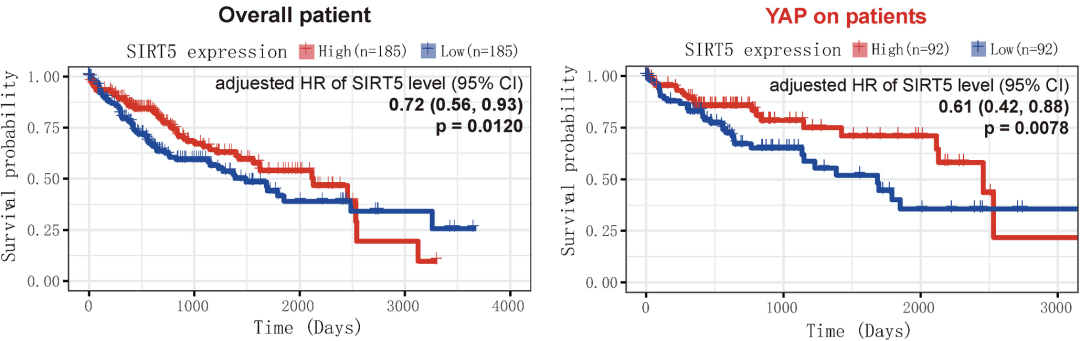
SIRT5表达下调与HCC患者的不良预后有关
为了研究SIRT5在体内HCC发病中的作用,研究人员通过尾静脉高压注射的方式,将含有癌基因YAP5SA或AKT1/NRasG12V的质粒导入WT小鼠或SIRT5-/-小鼠的肝脏,建立了小鼠肝癌模型。结果发现,与WT小鼠相比,SIRT5-/-小鼠的肿瘤更多,体积更大,存活时间更短。这些数据表明SIRT5的缺失与癌基因协同促进了HCC的发生和发展。
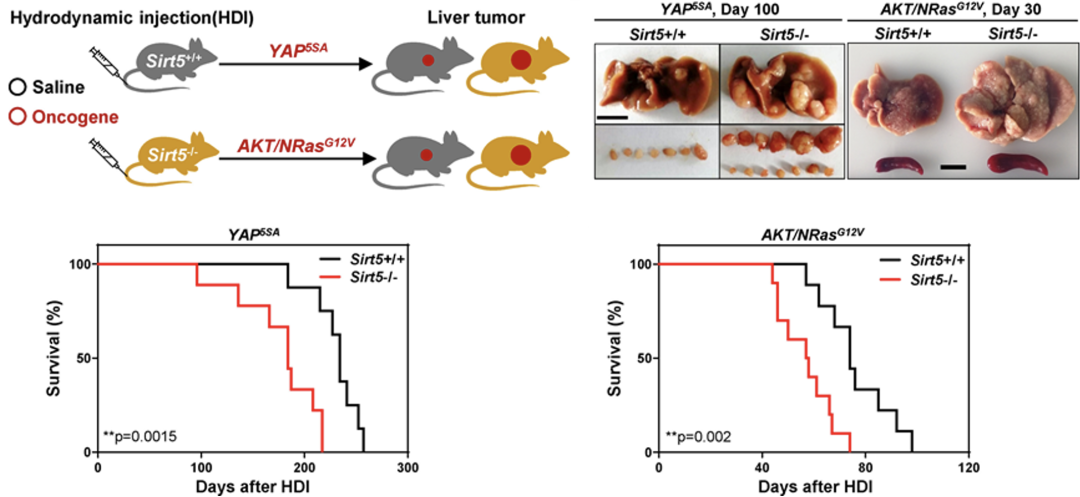
SIRT5缺陷与癌基因协同促进HCC的发展。
为了进一步阐明肝实质细胞SIRT5缺失和癌基因表达是HCC发生的原因。研究人员将YAP5SA和靶向SIRT5的shRNA元件插入到单个转座子中,通过高压注射将构建的载体转移到WT小鼠的肝实质细胞中。发现在将癌基因转入肝实质细胞的同时敲低SIRT5的表达,会促进HCC的发生,缩短小鼠的存活时间。
另一方面,如果将YAP5SA和SIRT5过表达质粒导入SIRT5-/-小鼠肝实质细胞,HCC的发生被显著抑制,小鼠的存活时间延长。
这些结果表明,肝细胞(而不是其他类型的细胞)中SIRT5缺陷可以与癌基因协同促进HCC的发生和发展。
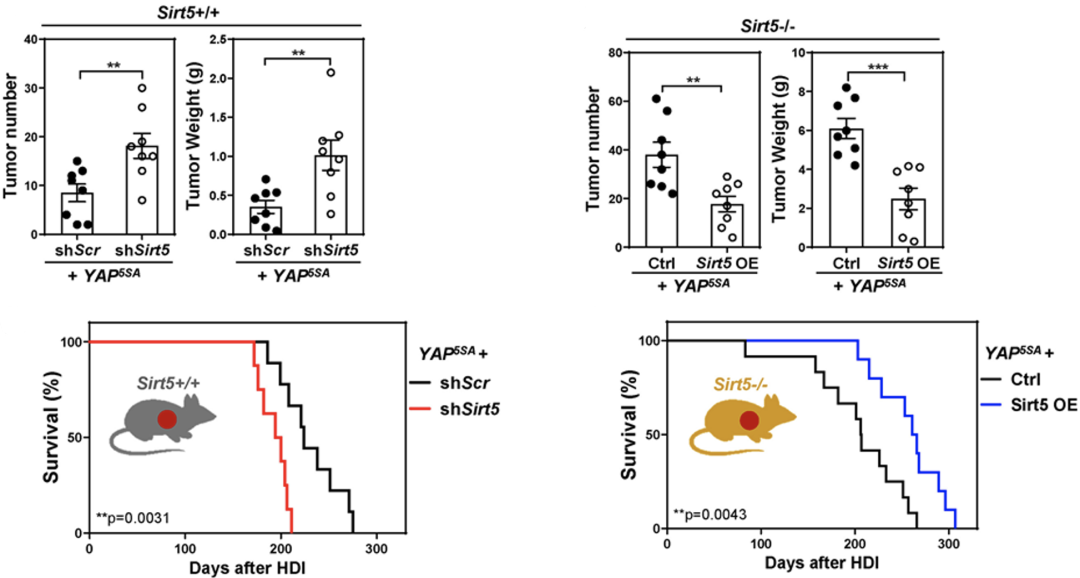
肝细胞中的SIRT5缺陷促进癌基因HCC的发展。
为了探索HCC sirt 5的机制,研究人员进行了进一步的研究。通过细胞系实验,他们发现SIRT5缺失并不影响肿瘤细胞的增殖和迁移能力。这排除了SIRT5缺陷通过增强肝细胞的致瘤性而促进HCC的可能性。
那么SIRT5缺失是如何促进肿瘤发生的呢?研究小组分析了肿瘤微环境中的免疫细胞组成,发现SIRT5-/-小鼠肝脏中M2极化巨噬细胞和MDSC的数量显著增加,而CD8 T细胞的数量显著减少。这表明SIRT5的缺陷创造了有利于肿瘤发生和发展的免疫抑制微环境。

SIRT5缺陷促进M2巨噬细胞的增加。
由于SIRT5的底物包括多种与代谢相关的酶,研究人员对高压下注射YAP5SA的SIRT5-/-和WT小鼠肝脏进行了代谢组学分析。结果发现SIRT5-/-小鼠肝脏胆汁酸生物合成途径上调。虽然SIRT5-/-小鼠肝脏中总胆汁酸的含量没有明显变化,但胆汁酸中T-CA(胆汁酸和胆酸与牛磺酸的结合物)的比例明显增加,SIRT5-/-小鼠血清中T-CA的浓度也明显高于WT小鼠。
为了探索SIRT5缺陷是否通过T-CA影响肿瘤微环境,研究人员进行了体外共培养实验和巨噬细胞极化实验,发现T-CA可以促进巨噬细胞M2极化,而这种作用依赖于T-CA的核受体FXR。这些数据表明,SIRT5缺陷的肝细胞可以通过增加T-CA的含量来促进巨噬细胞的M2极化。

SIRT5缺陷促进T-CA增加和巨噬细胞M2极化。
既然T-CA能引起免疫抑制,促进HCC的发生发展,那么中和T-CA能否逆转免疫抑制,从而抑制肿瘤生长呢?
为了找出这个问题,研究人员使用了临床上常用的消胆胺来治疗引入YAP5SA的小鼠。胆囊胺治疗不仅有效降低了小鼠肝脏和血清中T-CA的水平,而且显著减少了SIRT5-/-小鼠(而不是sirt 5/小鼠)中MDSC和M2极化的巨噬细胞的数量,并减少了肿瘤结节的数量和重量。这表明T-CA与消胆胺螯合能有效逆转MDSC和M2极化巨噬细胞引起的免疫抑制,抑制肿瘤生长。
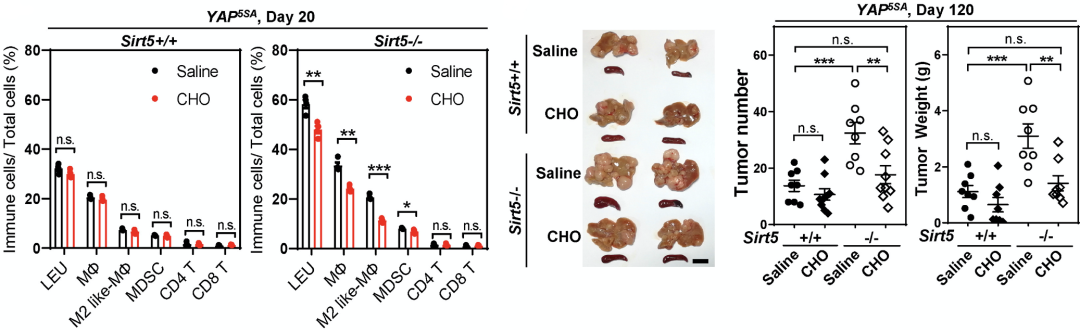
胆囊胺治疗可逆转免疫抑制并减轻肿瘤负担。
上述结果揭示了SIRT5缺陷增加肝脏和血清中T-CA水平的机制,T-CA促进巨噬细胞的M2极化,从而导致免疫抑制,促进小鼠肿瘤生长。为了探索人类HCC患者中是否存在相同的机制,研究人员分析了TCGA数据库中HCC患者的转录组数据和HCC患者的临床标本,发现SIRT5基因表达与TAM和M2巨噬细胞标记基因呈负相关。
与健康人相比,HCC患者血清T-CA水平明显升高,且高血清T-CA水平与肿瘤中TAM和M2巨噬细胞数量呈正相关。这些数据表明,在小鼠中发现的机制也存在于HCC患者中。
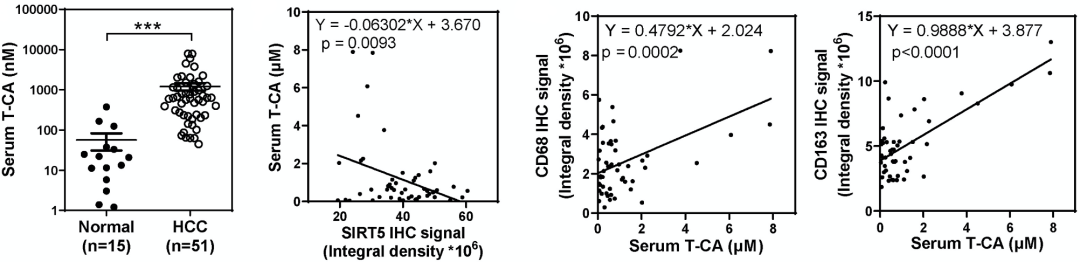
HCC患者血清T-CA浓度与M2巨噬细胞标志物呈正相关。
总的来说,本研究揭示了SIRT5低表达增加HCC T-CA含量,进而导致逃逸的机制。同时也提出了使用消胆胺治疗HCC患者的潜在治疗策略,对于SIRT5低表达或血清T-CA水平高的HCC患者具有重要意义。预计将进行进一步的临床试验,探讨消胆胺对HCC的治疗作用,从而为广大HCC患者带来希望。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。媒体或
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















