《自然·医学》:破解脑转移癌细胞对放疗耐药之谜 |
 |
来源:奇点蛋糕2022-04-29 11:15
Valiente的团队发现S100A9介导了脑转移癌的放疗抵抗,它可以作为一种潜在的生物标志物来预测患者对放疗的敏感性,从而达到个体化治疗的目的。
全脑放射治疗(WBRT)一直是转移性脑癌的主要治疗方法之一,尤其是对于那些没有手术机会的患者[1]。遗憾的是,目前的临床证据表明,全脑放疗并不能显著改善转移性脑癌患者的预后[2]。
因此,探索脑转移癌对放疗耐药的分子机制,寻找能够预测放疗敏感性的分子标志物,将有助于找到解决放疗耐药的方法,以及为患者制定个体化的放疗计划。
近日,西班牙国家癌症研究中心的Manuel Valiente教授团队发现了脑转移癌对全脑放疗耐药的新机制。
他们发现脑转移癌细胞可以高度表达和分泌S100A9蛋白,该蛋白可以与肿瘤细胞表面的受体RAGE结合,激活细胞内NF- B/JunB信号通路,介导放疗抵抗,这种抵抗可以被RAGE抑制剂FPS-ZM1逆转。
此外,他们还发现S100A9可以作为生物标志物(可以使用血液检测或肿瘤组织检测)来预测脑转移患者对全脑放疗的敏感性,从而给患者个体化放疗。
研究结果为脑转移瘤患者的个体化放射治疗提供了理论依据,发现了一种具有潜在临床应用价值的放射增敏剂,具有非常重要的临床转化意义。相关研究成果发表在著名期刊《自然 医学》上[3]。

文章首页截图
为了研究脑转移癌(BrM)对全脑放疗耐药的机制,Manuel Valiente教授团队首先构建了脑转移动物模型(肺腺癌细胞系H2030-BRM心内接种)和脑转移动物模型(TNBC细胞系E0771-BRM颅内接种)。
他们发现,与对照组相比,三种不同方案的全脑放疗都未能延长小鼠的存活时间,但奇怪的是,这两种细胞系在体外培养时对放疗非常敏感。
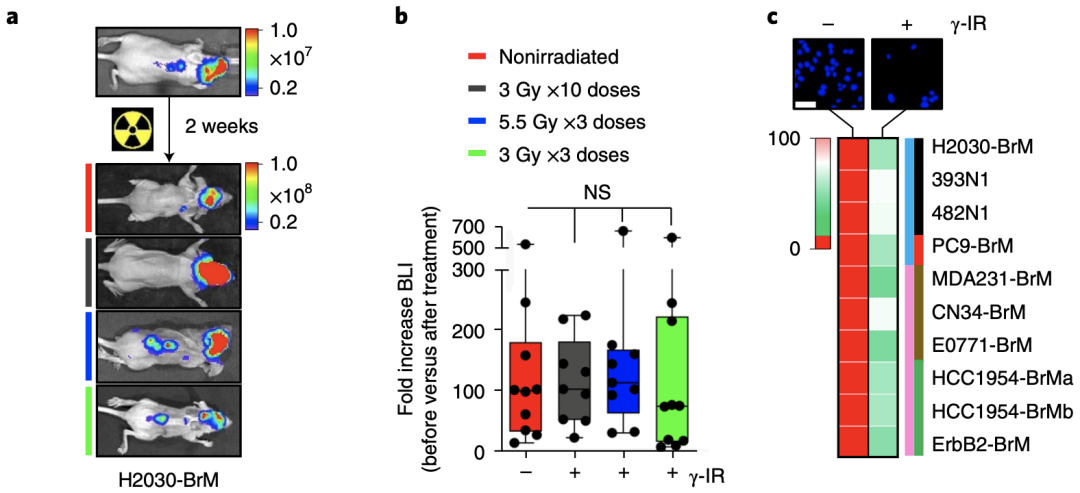
脑转移癌的动物模型对全脑放疗有抵抗性,但该细胞系在体外对放疗非常敏感。
这一有趣的现象让研究人员怀疑,是否是因为肿瘤细胞与脑组织接触,才会对放疗产生耐药性。
因此,他们将H2030-BRM或E0771-BRM细胞放在体外培养的脑组织薄片上,并采用与之前相同的辐射治疗。发现癌细胞确实对放疗产生了耐药性,这表明肿瘤生长的脑微环境中存在改变细胞对放疗敏感性的物质。
以往的研究发现,脑转移癌细胞与胶质细胞的相互作用在脑转移癌细胞的生长中起着重要的作用[4]。研究人员将脑转移癌细胞与胶质细胞共培养后发现,只有脑转移癌细胞与胶质细胞直接接触(分离两种细胞无效),特别是与星形胶质细胞接触,才会对放疗产生耐药性。
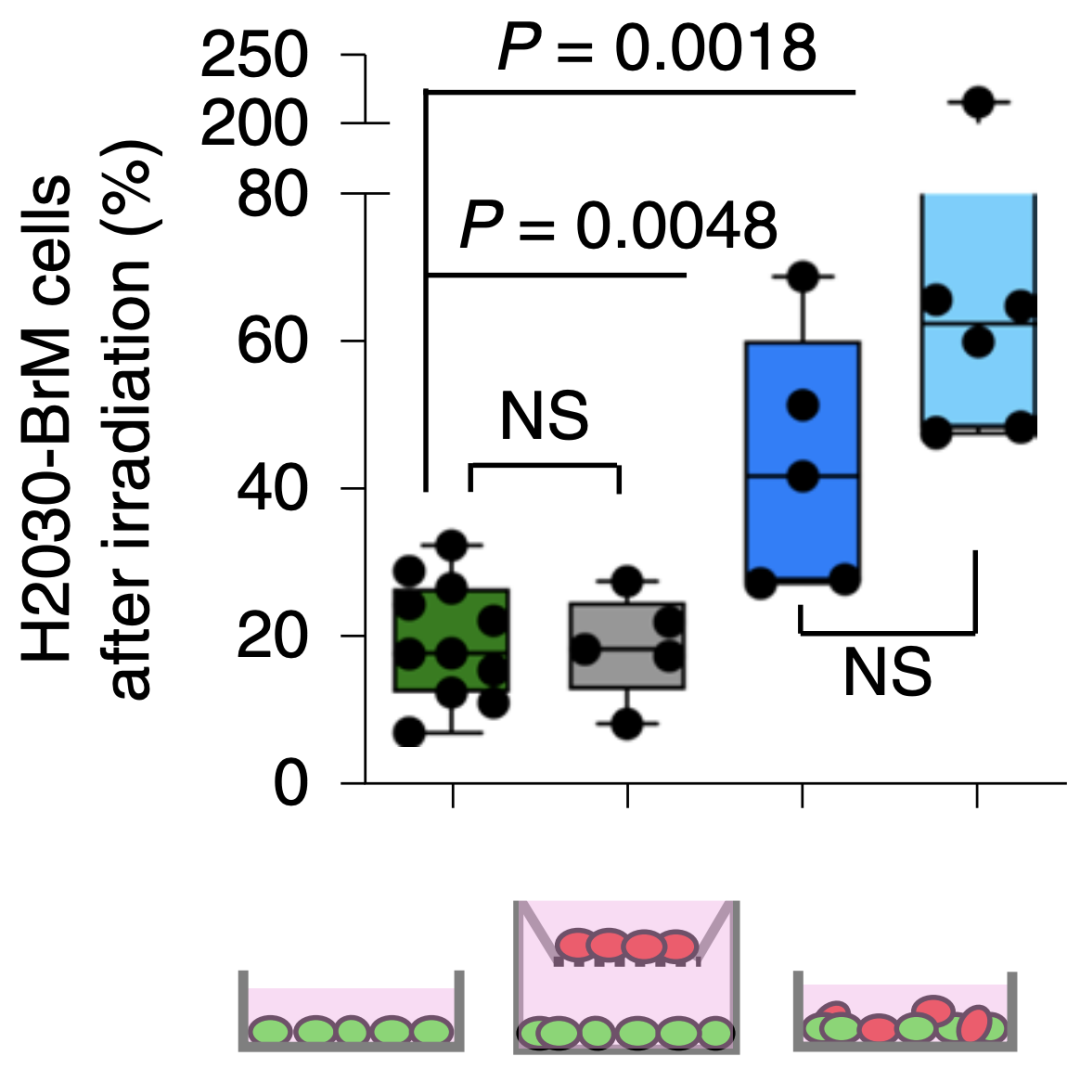
只有当转移性脑癌细胞与星形胶质细胞接触时,才能产生放疗抵抗。
为了研究分子机制,研究人员对对照细胞和共培养的脑转移癌细胞的RNA进行了测序,发现S100A9是最显著的上调基因,S100A9在动物模型和人脑转移癌标本中也有高表达。
然而,S100A9的高表达是由星形胶质细胞分泌的CXCL1和TGG诱导的。在体外培养的细胞中加入上述两种细胞因子,可以诱导脑转移癌细胞中S100A9的高表达,并对放疗产生耐药性。
这些研究表明,S100A9可能参与了脑转移癌细胞对放疗耐药的机制。
为了验证这一点,研究人员在体外将重组S100A9添加到对辐射敏感的脑转移癌细胞系中,发现
S100A9如何导致对放疗敏感的脑转移癌细胞对放疗产生耐药性?
通过转录组学分析,研究人员发现S100A9的受体RAGE在放射刺激后抵抗放疗的脑转移癌中高表达,在动物模型和人脑转移癌标本中也是如此。通路富集分析显示RAGE下游的NF- B信号通路被明显激活。
这些数据表明,脑转移癌细胞可以表达和分泌S100A9,并与辐射诱导的高表达RAGE受体结合,激活NF- B介导的放疗抵抗。
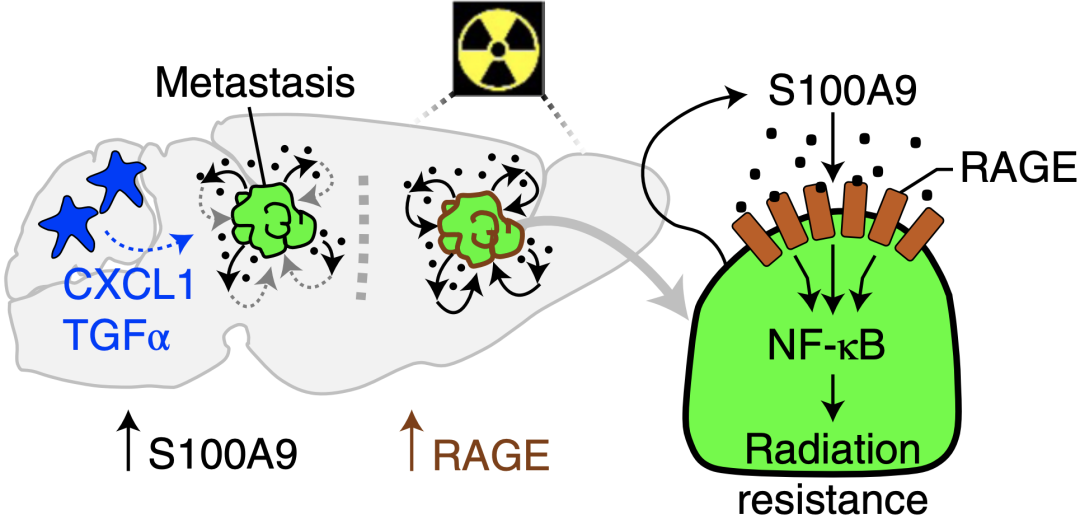
S100A9介导的脑转移癌细胞放疗抵抗机制
然后,研究人员在体内研究了S100A9对放疗敏感性的影响,构建了S100A9在H2030-BrM细胞中沉默的肺癌脑转移模型。
结果表明,肿瘤对放疗的耐药性消失,与对照组(H2030-BrM细胞型肺癌脑转移模型)相比,放疗显著延长了小鼠的存活时间。乳腺癌脑转移的动物模型也有类似的现象。
然后,研究人员在体内证实,S100A9实际上是通过激活NF- B/JunB信号通路来介导肿瘤的放疗抵抗。
S100A9不仅由肿瘤细胞表达,也由中性粒细胞和单核细胞分泌。为了验证肿瘤特异性分泌的S100A9是否介导放疗抵抗,研究人员构建了S100A9基因敲除小鼠模型,然后将野生型E0771-BRM细胞植入脑内,构建脑转移模型。结果表明,肿瘤对放疗仍有抵抗力。证明了放射治疗抵抗确实是由脑转移癌细胞分泌的S100A介导的。
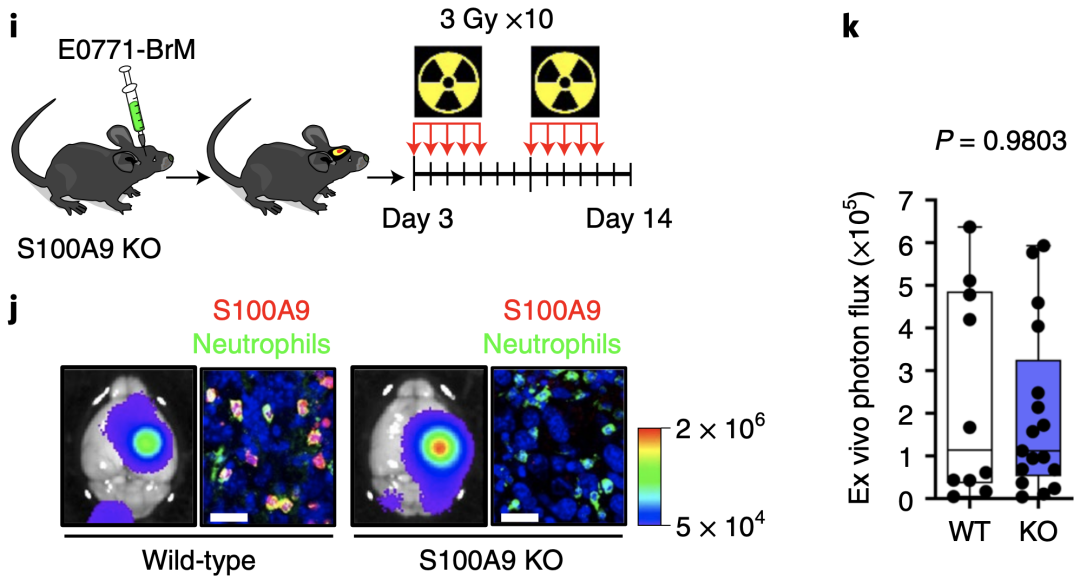
S100A9基因敲除小鼠脑转移模型对放疗的耐受性
鉴于S100A9与脑转移瘤放射敏感性之间的相关性,研究人员在临床人群中研究了S100A9与脑转移瘤患者(接受标准治疗,包括放疗)预后的关系。
通过分析肺癌(n=22)、乳腺癌(n=42)和黑色素瘤(n=34)脑转移患者的临床标本和随访数据,研究人员发现,S100A9在肺脑转移中的表达水平与全脑放疗后的肿瘤复发时间有关,S100A9在乳腺癌和黑色素瘤脑转移中的表达水平与生存率显著相关。这强烈表明S100A9作为预测放疗敏感性的标记物的价值。
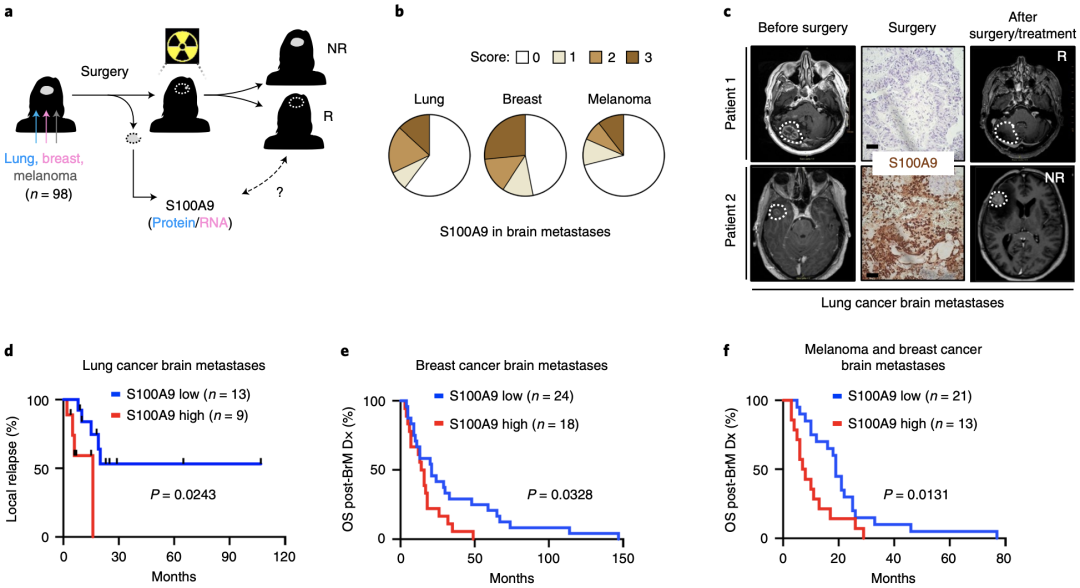
脑肿瘤标本S100A9水平可作为预测放疗敏感性的指标。
考虑到一些脑转移癌患者已经失去了手术的机会,无法获得颅内肿瘤样本来评估S100A9的表达水平,研究人员还研究了血液中S100A9的水平与患者对放疗的敏感性之间的关系。
通过分析71例脑转移癌患者的血样和临床资料,他们发现血液中S100A9的水平也可以用来预测接受标准治疗(包括放疗)的患者的预后,但需要更大规模的临床研究来验证。
为了让那些S100A9水平高的患者也能享受到放疗带来的好处,研究人员不禁思考,这种放疗抵抗是否可以逆转?
幸运的是,FPS-ZM1是一种现有的RAGE抑制剂,对血脑屏障具有非常好的渗透性[5]。在肺癌和乳腺癌脑转移小鼠中使用FPS-ZM1后,研究人员发现,原本对放疗有抵抗力的肿瘤对治疗变得敏感。
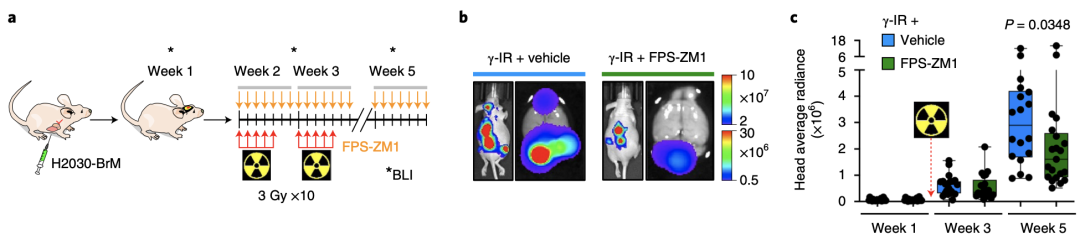
RAGE抑制剂FPS-ZM1可以逆转肿瘤的放疗耐药性。
总的来说,Valiente团队发现S100A9介导了脑转移癌的放疗抵抗,可以作为潜在的生物标志物来预测患者对放疗的敏感性,从而达到个体化治疗的目的。据了解,研究人员已经开始了一项前瞻性多中心研究,以评估S100A9对放疗敏感性的预测价值。
更重要的是,这种对放疗的抵抗可以被RAGE抑制剂逆转,RAGE抑制剂已经进入治疗阿尔茨海默病的临床试验阶段[6]。在不久的将来,这种药物可能真的作为放射增敏剂用于临床,以改善脑转移患者的预后
医药网新闻
- 相关报道
-
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















