顾伟团队发现,p53的这种点突变,可同时抑制铁死亡和促肿瘤转移 |
 |
来源:生物世界 2023-04-03 11:51
该研究发现,p53热点突变蛋白p53R175H可特异性与转录因子BACH1结合,发挥双重作用:一方面,解除BACH1对SLC7A11下调作用,从而抑制铁死亡,促进肿瘤生长肿瘤转移是导致癌症患者死亡的主要原因,占癌症死亡原因的90%以上。深入研究肿瘤转移机制及药物标靶对干预肿瘤转移具有重要的意义。p53基因是重要的抑癌基因,p53基因的突变是多种肿瘤发生的关键环节之一,40-50%的肿瘤患者存在p53基因的突变。相比于单纯删除p53基因,p53基因错义突变可产生新的表型,其中重要一方面即促进肿瘤的转移,其主要原因可能为突变型p53蛋白不仅丧失了野生型p53蛋白的抑癌功能,还可通过gain-of-function(功能增益)机制干预其他信号通路,从而获得促转移功能。
针对突变型p53蛋白的干预一直是药物开发领域的热点,然而不同的突变型p53蛋白的生物学调控及其特异性靶向干预一直不清楚。
近日,美国哥伦比亚大学顾伟教授团队(苏振毅博士为第一作者)在Nature Cancer期刊在线发表了题为:Specific regulation of BACH1 by the hotspot mutantp53R175Hreveals a distinct gain-of-function mechanism的研究论文。
该研究发现,p53热点突变蛋白p53R175H可特异性与转录因子BACH1结合,发挥双重作用:一方面,解除BACH1对SLC7A11下调作用,从而抑制铁死亡,促进肿瘤生长;另一方面,通过上调促转移靶点的表达,促进BACH1依赖的肿瘤转移。
在机制上,p53R175H介导的BACH1功能的双向调控,依赖于它招募组蛋白去甲基酶LSD2靶向启动子和差异调节转录的能力。
这些研究数据表明,BACH1作为p53R175H执行其特定gain-of-function(功能增益)的独特的伙伴,还表明了不同的p53突变体可通过不同的机制发挥功能增益作用。这也为针对携有不同类型p53突变的癌症患者的个体化治疗提供了治疗靶标。

研究团队通过蛋白质组学筛选发现,p53热点突变蛋白p53R175H体内可以特异性与转录因子BACH1结合,从而干预BACH1的生物学功能,而其他p53热点突变蛋白(如p53R248W、p53R273H等)不与BACH1结合,也不影响其功能。
BACH1是一个具有双向调控功能的转录因子,一方面可转录抑制一批与氧化应激调节相关的基因,促进铁死亡(ferroptosis)的发生,另一方面,BACH1可转录激活另一批与肿瘤转移相关的基因,从而促进肿瘤的转移。
p53R175H与BACH1特异性结合,一方面解除BACH1对SLC7A11等铁死亡相关基因的转录抑制,从而拮抗铁死亡,促进肿瘤生长;另一方面,增强BACH1对CEMIP(细胞迁移诱导透明质酸酶-1)等促转移分子的转录激活,从而加速肿瘤的转移。
该研究进一步发现,p53热点突变蛋白p53R175H之所以可以同时调控BACH1抑制性与激活性靶点,机制上在于p53R175H可招募一个组蛋白H3K4me1/2去甲基化酶LSD2,形成p53R175H-BACH1-LSD2三元调控复合体,通过影响靶基因组蛋白的甲基化状态,实现对BACH1转录靶点的选择性调控。
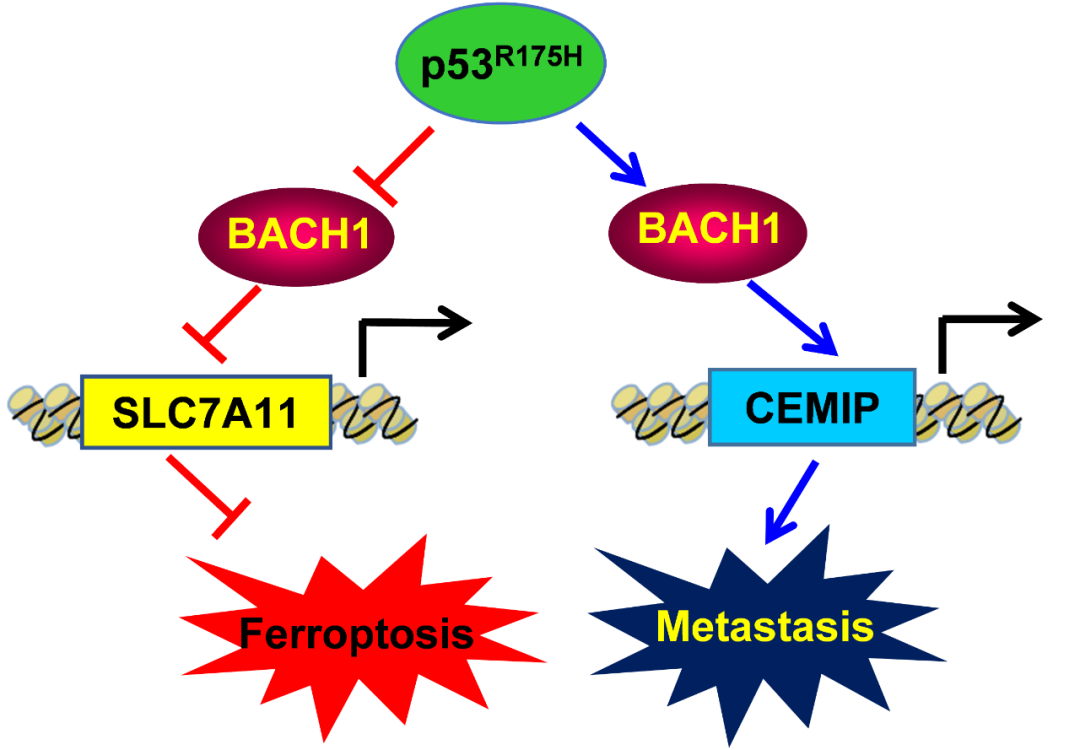
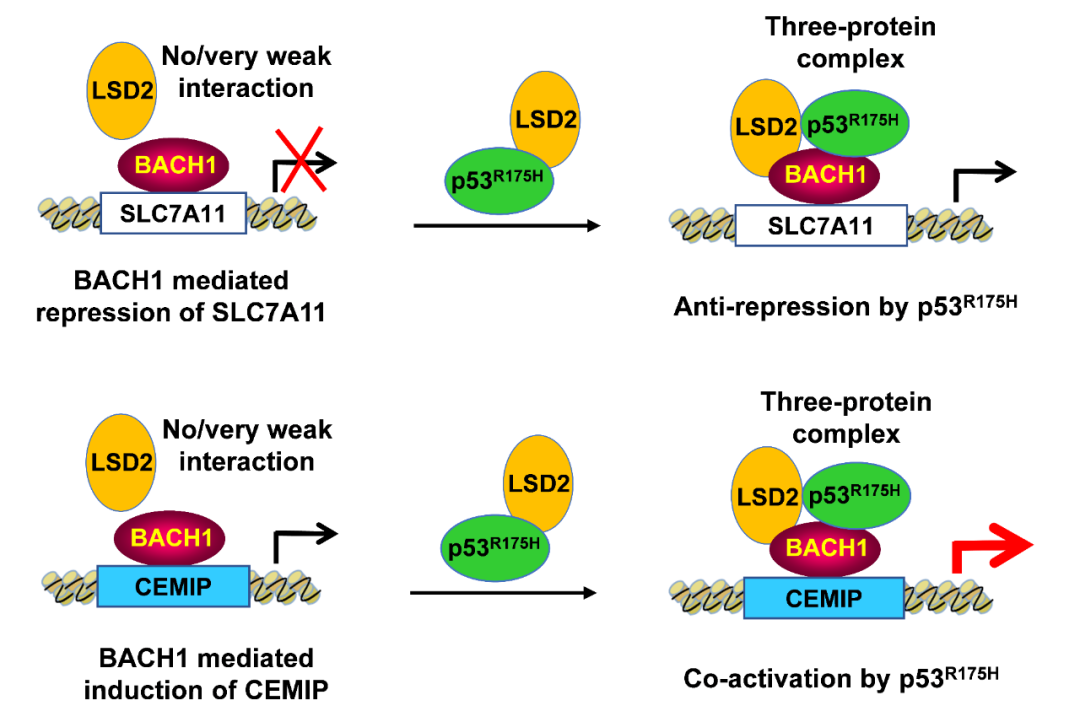
p53R175H通过BACH1发挥抑制铁死亡、促进肿瘤转移的功能和机制
该研究揭示了BACH1、LSD2是介导p53热点突变蛋白p53R175H促转移作用的关键蛋白,失活BACH1或LSD2可以有效阻断p53R175H介导的肿瘤转移。
该研究首次提出并证明了不同突变型p53发挥的gain-of-function机制是可以不同的,这为针对携有不同类型p53突变的癌症患者的个体化治疗提供了可能。未来可以以BACH1或LSD2为药物靶标,设计和开发出针对p53R175H突变患者特异性的抗转移药物。
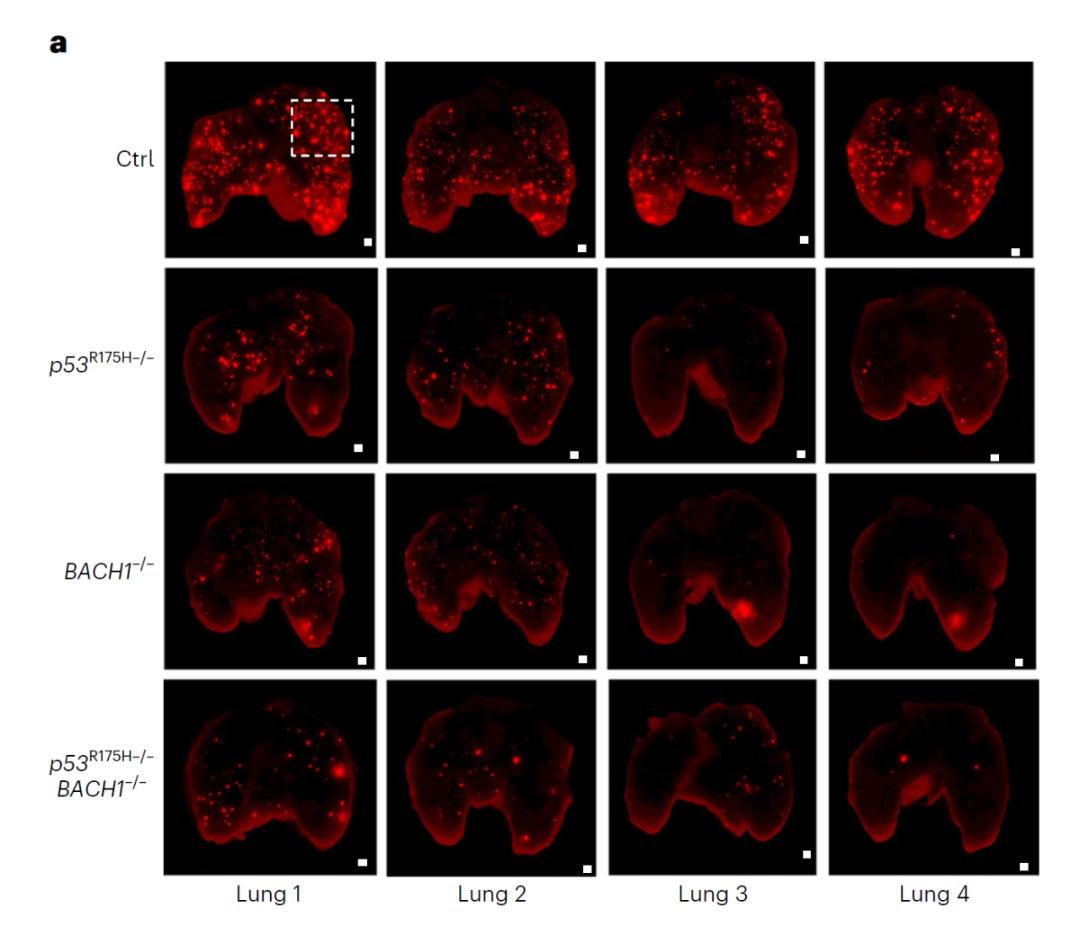
敲除p53R175H或BACH1可有效抑制肿瘤向肺部的转移
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 迈迪斯亮相HICOOL2025全球创业者峰会 微创导航技术破解临床穿刺难题 (2025-10-24)
- 清华大学最新Cell论文:娄智勇/饶子和团队发现冠状病毒复制模板循环与RNA加帽的协同机制 (2025-10-24)
- 攻克LAM肺修复难题!Nature Communications重磅:mTOR-IL-6轴驱动肺泡细胞衰老,双靶联合治疗或成破局关键 (2025-10-24)
- 抗肿瘤药物甲氨蝶呤血药浓度快速监测研究获进展 (2025-10-24)
- 每 36 个娃就有 1 例,但病因成谜?! Transl Psychiatry:科学家破译自闭症患者的细胞“求救信” (2025-10-24)
- Nat Metabol:癌细胞也爱“吃醋”?科学家发现巨噬细胞竟是肝癌转移的“燃料供应商”! (2025-10-24)
- 全球首个百亿级人类基因组基础模型Genos发布! (2025-10-23)
- CRISPR编辑肝类器官破解凝血因子VII缺乏症难题!Haematologica开辟罕见出血病自体治疗新范式 (2025-10-23)
- 《细胞》:肿瘤被“坑”杀!哈佛大学团队发现全新抗癌结构,杀伤性T细胞可在里面直接杀死癌细胞 (2025-10-23)
- Nature子刊:鲁明/钦伦秀团队发现肿瘤相关巨噬细胞促进肝癌转移的新机制 (2025-10-23)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















