Molecular Cancer |
 |

RNA甲基化是一种常见的转录后修饰(post-transcriptional modification),在基因表达调控中扮演着关键角色。近年来,研究人员发现,RNA甲基化不仅在正常生理过程中重要,而且在肿瘤的发生和发展中也起到关键作用。尤其是它在调控肿瘤免疫和免疫逃逸方面的功能,引起了广泛关注。
RNA甲基化的类型与机制
目前已知的RNA甲基化类型超过170种,其中最主要的包括N6-甲基腺嘌呤(m6A)、5-甲基胞嘧啶(m5C)、N1-甲基腺嘌呤(m1A)、N7-甲基鸟嘌呤(m7G)和3-甲基胞嘧啶(m3C)。这些修饰通过特定的蛋白质进行调控:
写入者(Writers):如METTL3和METTL14等,催化甲基基团的添加。
擦除者(Erasers):如FTO和ALKBH5等,去除甲基基团。
读取者(Readors):如YTHDF1和IGF2BP1等,识别并结合甲基化修饰,调控RNA的功能。
其中,m6A是最常见的RNA甲基化形式,广泛存在于mRNA、rRNA、tRNA、长链非编码RNA(lncRNA)和小RNA(sRNA)中。m6A甲基化调控着RNA的剪接、翻译、稳定性和运输等关键生物过程。
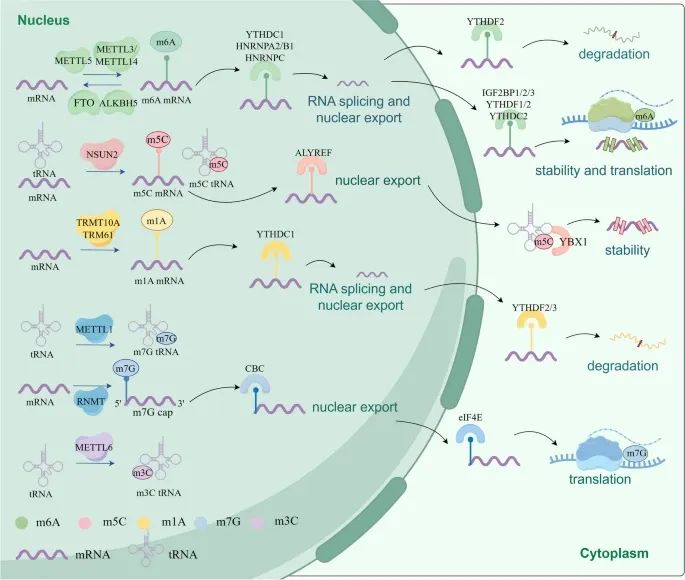
RNA甲基化的机制以及RNA甲基化如何调控RNA的命运和生物功能(Credit:Molecular Cancer)
RNA甲基化的写入者(Writers):m6A:METTL3和METTL14;m5C:NSUN2;m1A:TRMT10A;m7G:METTL1。
RNA甲基化的擦除者(Erasers):m6A:FTO和ALKBH5。
RNA甲基化的读取者(Readors):IGF2BP1/2/3、YTHDF1/2/3、YTHDC1/2/3、YBX1、ALYREF、CBC、eIF4E等蛋白质可以识别并结合RNA上的甲基化修饰。
RNA甲基化对RNA命运的调控:RNA甲基化可以调控mRNA的剪接、导出、稳定性、降解和翻译等生物功能。
关键蛋白:METTL3 (methyltransferase-like 3),FTO (obesity-associated protein),ALKBH5 (AlkB homolog 5),TET1/2/3 (ten-eleven translocation proteins 1/2/3),ALKBH1 ( -ketoglutarate-dependent dioxygenase ABH1)
RNA甲基化在肿瘤中的作用
大量研究表明,RNA甲基化在多种癌症的发生和进展中起着至关重要的作用。例如,m6A写入者METTL3在肝细胞癌(HCC)中维持高水平的糖酵解,并诱导代谢重编程。这种酶还影响巨噬细胞的极化、树突状细胞的活化、效应T细胞的分化和增殖以及免疫检查点的表达。
METTL3在HCC中的作用:研究表明,METTL3通过上调葡萄糖转运蛋白(GLUT1)的表达,促进糖酵解进程,从而为的增殖提供必要的能量条件。此外,METTL3还通过调控HIF-1 的表达,促进缺氧条件下肿瘤细胞的存活和增殖。
NSUN2在食道癌中的作用:NSUN2通过稳定GRB2的表达,增强的增殖和迁移能力。另有研究表明,NSUN2能够通过调控CDKN1A的表达,抑制脂肪生成,表明NSUN2在肿瘤代谢重编程中也起到重要作用。
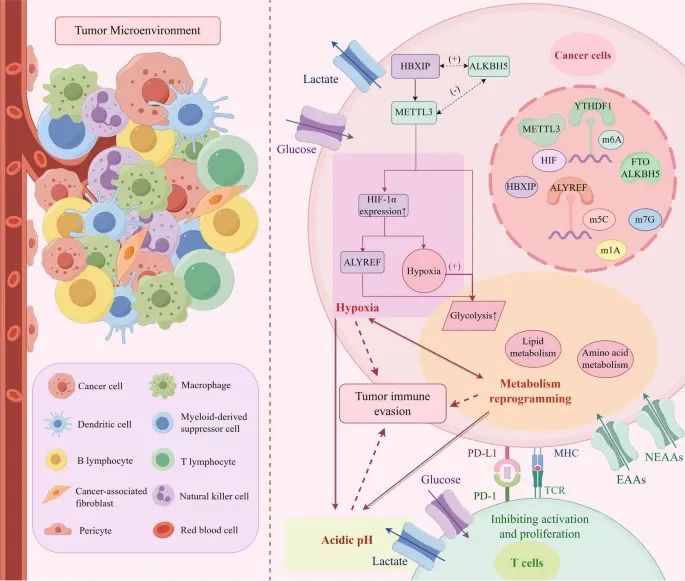
肿瘤微环境(TME)的组成以及RNA甲基化如何通过缺氧、代谢重编程和酸性环境来促进肿瘤免疫逃逸(Credit:Molecular Cancer)
肿瘤微环境的组成:肿瘤微环境包括免疫细胞、基质细胞、细胞外基质、血管和其他可溶性因子。
RNA甲基化在肿瘤免疫逃逸中的作用:缺氧诱导因子(HIF)通过m6A、m5C、m1A和m7G RNA甲基化来调控免疫抑制性TME的形成,并促进肿瘤免疫逃逸。RNA甲基化调控生物代谢,包括葡萄糖代谢、脂质代谢和氨基酸代谢,导致免疫细胞和酸性环境的形成,从而促进肿瘤发生、血管生成和肿瘤细胞增殖。这些变化进一步加重组织缺氧,促进肿瘤进展。
代谢重编程与肿瘤进展:葡萄糖代谢:通过m6A、m5C、m1A和m7G RNA甲基化调控葡萄糖代谢途径,促进肿瘤细胞的糖酵解;脂质代谢:RNA甲基化调控脂质代谢,影响脂肪酸的合成、降解和储存,促进肿瘤细胞的膜结构和能量生成;氨基酸代谢:RNA甲基化调控非必需氨基酸(NEAAs)和必需氨基酸(EAAs)的代谢,影响肿瘤细胞的生长和免疫逃逸。
相互作用与协同作用:缺氧、代谢重编程和酸性环境相互作用,共同促进肿瘤免疫逃逸;缺氧环境激活HIF,进一步调控RNA甲基化,促进肿瘤进展;代谢重编程导致酸性环境的形成,影响免疫细胞功能,加剧肿瘤免疫逃逸。
RNA甲基化与肿瘤免疫
RNA甲基化在肿瘤免疫调控中发挥着重要作用。它通过影响肿瘤微环境(TME)中的免疫细胞和免疫因子的失调,调节肿瘤免疫逃逸机制。主要机制包括:
调控免疫细胞功能:RNA甲基化通过调控免疫细胞如巨噬细胞、树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的功能,影响肿瘤免疫逃逸。例如,m6A写入者METTL3促进巨噬细胞的M1极化,增强其抗肿瘤能力,而FTO则通过抑制NF- B信号通路,抑制M1和M2巨噬细胞的极化。
调控TME稳态:RNA甲基化通过调控糖酵解、脂肪代谢和氨基酸代谢,影响TME的代谢重编程,进而影响肿瘤免疫。例如,METTL3通过上调GLUT1的表达,促进糖酵解进程,为肿瘤细胞的增殖提供条件。
调控免疫检查点:RNA甲基化通过调控免疫检查点如PD-1/PD-L1的表达,影响肿瘤免疫逃逸。研究表明,m6A读取者YTHDF1在DCs中上调MHC-II的表达,增强抗原呈递能力,从而增强免疫反应。
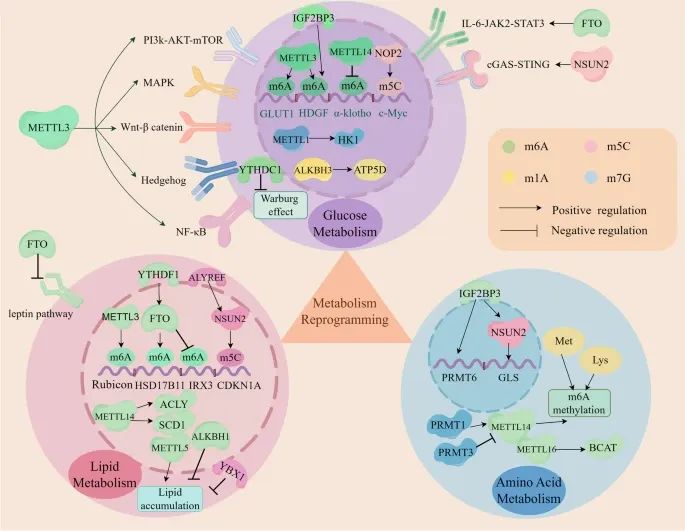
RNA甲基化如何参与肿瘤微环境(TME)的代谢重编程,包括葡萄糖代谢、脂质代谢和氨基酸代谢(Credit:Molecular Cancer)
RNA甲基化在代谢重编程中的作用:RNA甲基化调控与糖酵解相关基因(如GLUT1、Gys2、HDGF)和信号通路(如PI3K-AKT、mTORC1、MAPK、Wnt- catenin、Hedgehog、NF- B、IL-6/JAK2/STAT3、cGAS/STING)的表达,通过这些调节因子(如METTL1、METTL3、METTL14、NOP2、NSUN2、FTO、ALKBH3、IGF2BP3、YTHDC1)增强Warburg效应。
葡萄糖代谢:m6A、m5C和m7G甲基化通过调控糖酵解相关基因和信号通路,促进葡萄糖代谢。例如,METTL3通过上调GLUT1的表达,增强糖酵解进程。
脂质代谢:m6A和m5C甲基化加速脂质积累。具体而言,m6A和m5C甲基化调控脂质代谢相关基因(如ACLY和SCD1)的表达,促进脂肪酸的合成和储存。
氨基酸代谢:m6A、m5C和m7G甲基化调控谷氨酰胺、精氨酸、蛋氨酸和赖氨酸的代谢。例如,BCAT1(支链氨基酸转氨酶1)在AML中通过重编程BCAA代谢促进癌症发生。
代谢重编程的影响:这些甲基化修饰影响肿瘤细胞的免疫原性、增殖、免疫逃逸以及肿瘤进展。例如,m6A读取者IGF2BP3通过稳定PRMT1 mRNA,调控蛋白精氨酸甲基转移酶1(PRMT1)的表达,从而影响肿瘤细胞的功能。
YTHDF1在DCs中的作用:通过敲除YTHDF1基因,研究人员发现DCs中的MHC-II表达显著增加,IL-12的分泌也有所增强,从而提升了适应性免疫反应。
METTL3在MDSCs中的作用:研究发现,敲除METTL3基因能够显著减少MDSCs的积累,从而增强CD8+ T细胞的活化和增殖。
FTO在肿瘤中的作用:FTO抑制剂能够通过抑制肿瘤细胞的糖酵解进程,逆转CD8+ T细胞的活化和效应状态。结合FTO抑制剂和抗PD-L1治疗,有望显著提高抗肿瘤免疫反应。
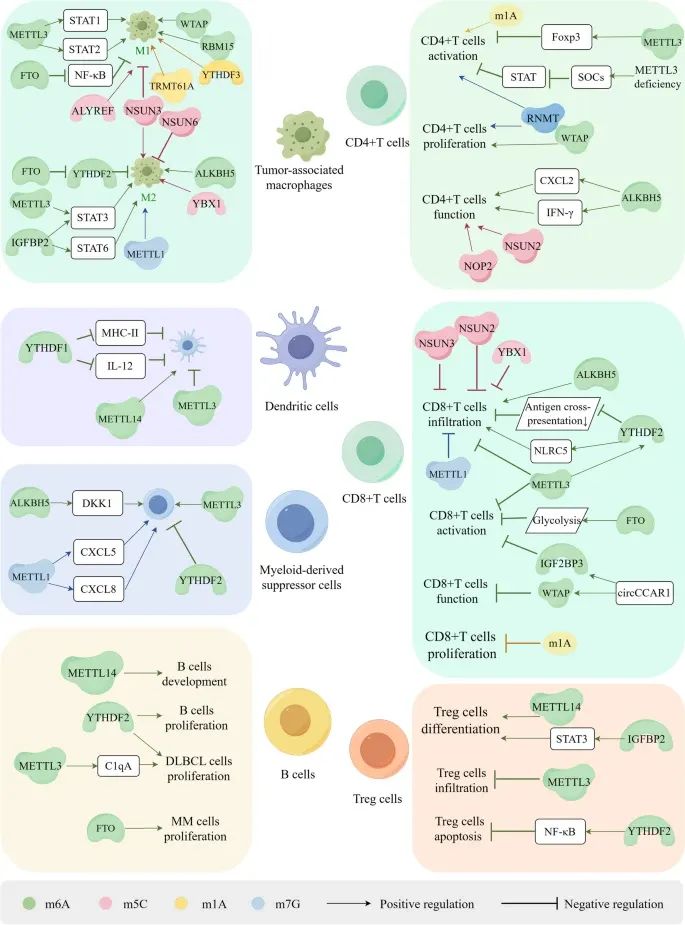
RNA甲基化如何在肿瘤微环境(TME)中调控免疫细胞的生物功能,包括免疫细胞的分化、发育、浸润、活化、增殖和凋亡(Credit:Molecular Cancer)
免疫细胞的分化和发育:RNA甲基化在免疫细胞的分化和发育中起重要作用。例如,m6A和m5C甲基化调控CD8+ T细胞的浸润和活化,并介导其功能障碍。
肿瘤相关巨噬细胞(TAMs)的极化:RNA甲基化促进肿瘤相关巨噬细胞(TAMs)向M1型或M2型巨噬细胞的极化;TAMs的M1型巨噬细胞具有抗肿瘤作用,而M2型巨噬细胞则具有促肿瘤作用。
树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的增殖和浸润:RNA甲基化调控树突状细胞(DCs)、髓源性抑制细胞(MDSCs)和调节性T细胞(Tregs)的增殖和浸润。例如,m6A甲基化通过调控DCs的抗原呈递能力,影响免疫反应。
T细胞的分化和发育:RNA甲基化在T细胞的分化和发育中起重要作用。m1A和m7G甲基化参与CD4+ T细胞和CD8+ T细胞的活化、浸润和增殖,但这些过程中m1A和m7G的具体调控机制尚需进一步研究。
RNA甲基化在肿瘤免疫反应和逃逸中的作用:RNA甲基化通过影响免疫细胞的分化、发育、浸润、活化、增殖和凋亡,调控肿瘤免疫反应和逃逸。例如,m6A和m5C甲基化通过抑制CD8+ T细胞的浸润和活化,介导其功能障碍,从而促进肿瘤免疫逃逸。
RNA甲基化在免疫治疗中的潜力
随着对RNA甲基化在肿瘤免疫调控中作用的深入研究,研究人员开始探索其在免疫治疗中的应用潜力。通过靶向RNA甲基化调控蛋白,有望开发出新的免疫治疗策略,提高癌症治疗的效果。
靶向METTL3:研究发现,抑制METTL3的表达能够显著减少MDSCs的积累,从而增强CD8+ T细胞的活化和增殖。靶向METTL3的抑制剂有望成为一种新的免疫治疗手段。
靶向FTO:FTO作为一种去甲基酶,其抑制剂已被证明能够通过抑制肿瘤细胞的糖酵解进程,逆转CD8+ T细胞的活化和效应状态。结合FTO抑制剂和抗PD-L1治疗,有望显著提高抗肿瘤免疫反应。
靶向YTHDF1:抑制YTHDF1的表达能够增强树突状细胞的抗原呈递能力,从而增强免疫反应。研究表明,YTHDF1抑制剂有望提高癌症患者对免疫治疗的响应率。
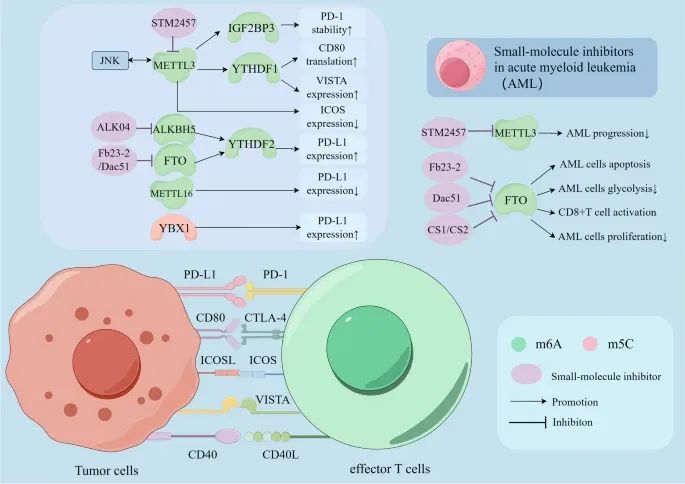
RNA甲基化如何通过其调控因子调节免疫检查点的表达,并且在急性髓性白血病(AML)中,几种小分子抑制剂联合免疫检查点阻断疗法的应用(Credit:Molecular Cancer)
共抑制性受体-配体复合物:包括PD-1/PD-L1、CTLA-4/CD80、VISTA等。这些复合物通过与肿瘤细胞上的相应配体结合,向T细胞传递负性信号,从而抑制T细胞的抗肿瘤反应。
共刺激性受体-配体复合物:包括CD40/CD40L、ICOS/ICOSL等。这些复合物通过与肿瘤细胞上的相应配体结合,向T细胞传递正性信号,从而增强T细胞的抗肿瘤反应。
RNA甲基化调控免疫检查点的机制:m6A和m5C甲基化通过调控免疫检查点的表达、翻译和稳定性,影响其对免疫治疗的敏感性。例如,免疫检查点PD-1、CTLA-4、ICOS、VISTA和CD40L通过与肿瘤细胞上的相应配体结合,触发T细胞反应的负性或正性信号。
RNA甲基化的调控因子:参与调控免疫检查点的RNA甲基化调控因子包括METTL3、ALKBH5、FTO和METTL16等。这些调控因子通过调节m6A和m5C甲基化,影响免疫检查点的功能。
小分子抑制剂的应用:针对METTL3和FTO的几种小分子抑制剂,包括STM2457、Alk-04、FB23-2和Dac51等,可以抑制m6A甲基化过程,并应用于AML的治疗。这些小分子抑制剂联合免疫检查点阻断疗法,有望提高AML患者的治疗效果。
RNA甲基化在肿瘤免疫中的作用及其在免疫治疗中的潜力正逐渐被揭示。通过靶向RNA甲基化调控蛋白,有望开发出新的免疫治疗策略,提高癌症治疗的效果。未来的研究需要进一步探索RNA甲基化在肿瘤免疫中的具体机制,并开发更多的RNA甲基化调控剂,以期在临床上取得突破。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















