生长抑素受体5与天然肽和药物分子的激活机理研究获得进展 |
 |
来源:上海药物所 2024-07-10 10:20
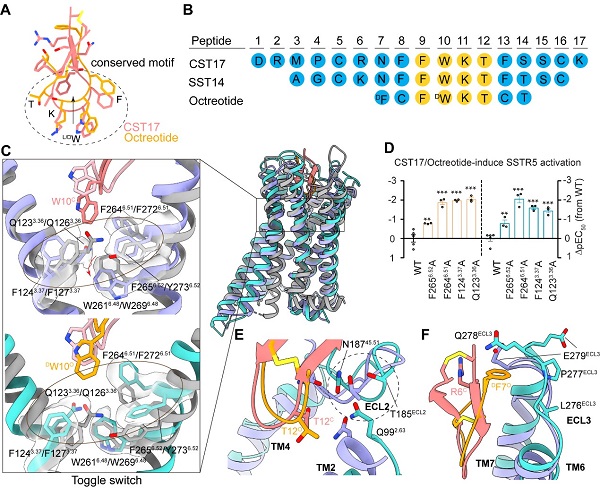
该研究利用冷冻电子显微镜技术,解析了天然多肽激动剂CST17和临床抗肿瘤药物octreotide分别激活SSTR5并结合下游Gi蛋白的三维复合物结构,分辨率分别为2.7和2.9埃。生长抑素受体(SSTRs)是一类G蛋白偶联受体,共有五种亚型(SSTR1-SSTR5)。其中,SSTR5是内分泌疾病和的潜在靶点。
生长抑素(SST)是SSTRs的天然配体。皮质抑素(CST)是一种与所有SSTRs亚型亲和力很高的神经肽,与SST具有高度的结构同源性。然而,CST识别和调控SSTRs的作用机制尚不明确。
CST17与SST14均能够激活SSTR5,但激活机制未知。美国食品药品监督局批准的生长抑素激动剂合成药物奥曲肽(octreotide)对SSTR2具有较高亲和力,并可以有效激活SSTR5,已用于治疗肢端肥大症和神经内分泌肿瘤等疾病。
尽管多种靶向SSTRs的SST类似物已被开发并用于临床,但由于SSTR亚型之间序列高度同源,开发出能够高选择性调控特定亚型并最大限度减少非靶向效应的药物具有挑战性。因此,阐明SSTR5与配体识别和激活的分子机制,对设计新型高选择性SSTR5激动剂具有积极意义。
中国科学院上海药物研究所徐华强与赵丽华团队在《美国国家科学院院刊》(PNAS)上在线发表了题为Structural basis for activation of somatostatin receptor 5 by cyclic neuropeptide agonists的研究论文。该研究利用冷冻电子显微镜技术,解析了天然多肽激动剂CST17和临床抗肿瘤药物octreotide分别激活SSTR5并结合下游Gi蛋白的三维复合物结构,分辨率分别为2.7和2.9埃。
该研究发现,CST17和octreotide的结合会引起SSTR5中由TM3和TM6组成的 疏水锁 重排,并导致TM6向外运动,从而使Gi蛋白与受体结合并启动下游信号传导。结构和功能分析显示,SSTR5细胞外环坏区ECL2和ECL3对CST17与octreotide具有不同的识别模式,解释了它们作为激动剂的选择性差异,阐明了SSTR5的激活机制和与肽激动剂识别的分子基础,为针对SSTR5开发新型高选择性、低副作用的药物来治疗肢端肥大症、神经内分泌肿瘤等疾病奠定了结构基础。
研究工作得到国家、国家重点研发计划、中国科学院战略性先导科技专项(B类)、中国科学院青年创新促进会会员项目以及上海市等的支持。该研究的冷冻电镜数据由上海药物所高峰电镜中心收集。
上海药物所解析生长抑素受体5与天然肽和药物分子的激活机理
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















