Nature:新研究发现桥接重组酶机制,有望开发下一代可编程基因组设计系统 |
 |
来源:100医药网 2024-07-17 13:17
研究发现了一种DNA重组酶,这种酶利用非编码RNA对目标DNA分子和供体DNA分子进行序列特异性选择,允许用户确定任何所需的基因组目标序列和任何要插入的供体 DNA 分子。在一项新的研究中,来自加州大学伯克利分校、Arc研究所、斯坦福大学医学院和东京大学的研究人员发现了桥接重组酶机制(bridge recombinase mechanism),这是一种以可编程方式重组和重排 DNA 的精确而强大的工具,也是基因工程领域的一次飞跃。相关研究结果发表在2024年6月27日的Nature期刊上,论文标题为 Bridge RNAs direct programmable recombination of target and donor DNA 。

这些作者发现了一种DNA重组酶,这种酶利用非编码RNA对目标DNA分子和供体DNA分子进行序列特异性选择。这种桥接 RNA 是可编程的,允许用户确定任何所需的基因组目标序列和任何要插入的供体 DNA 分子。
论文通讯作者、Arc 研究所核心研究员、加州大学伯克利分校生物工程助理教授 Patrick Hsu 博士说, 这种桥接RNA 系统是一种全新的生物编程机制。桥接重组(bridge recombination)可以通过序列特异性插入、切除、倒位等方式修饰遗传物质,从而实现超越CRISPR的活体基因组文字处理器。
论文第一作者为Arc研究所资深科学家 Matthew Durrant 博士和加州大学伯克利分校生物工程研究生 Nicholas Perry。这项研究是与 Arc 研究所核心研究员、斯坦福大学生物化学助理教授 Silvana Konermann 博士和东京大学结构生物学教授 Hiroshi Nishimasu 博士的实验室合作完成的。
可编程 RNA
这种桥接重组系统源于插入序列 110(insertion sequence 110, IS110)元件,它是无数种转座元件,也称为跳跃基因中的一种,可在微生物基因组内部或之间进行剪切和粘贴。转座元件遍布所有生命形式,为了生存,它们已经进化成专业的 DNA 操作机器。IS110元件非常简约,仅由一个编码重组酶的基因和侧翼DNA片段组成,而侧翼DNA片段的作用在此之前一直是个谜。
Hsu实验室发现,当 将IS110从基因组中切除时,非编码 DNA 的末端会连接在一起,产生一个折叠成两个环的 RNA 分子 桥接 RNA(bridge RNA)。其中的一个环与 IS110 元本身结合,而另一个环则与插入 IS110元件的目标DNA 结合。桥接 RNA 是双特异性引导分子的第一个例子,它通过碱基配对相互作用确定目标 DNA 和供体 DNA 的序列。
桥接 RNA 的每个环都是独立可编程的,从而允许科学家们混合和匹配任何感兴趣的目标 DNA 和供体 DNA 序列。这意味着该系统可以远远超出它插入 IS110 元件本身的天然作用,能够将任何理想的基因货物(如有缺陷的致病基因的一个功能性拷贝)插入到任何基因组位置。在这项新的研究中,这些作者证实在大肠杆菌中插入所需基因的效率超过 60%,对正确基因组位置的特异性超过 94%。
Perry说, 这些可编程的桥接 RNA 将 IS110 与其他已知的重组酶区分开来,后者缺乏 RNA 成分,无法进行编程。就好像桥接 RNA 是一个通用电源适配器,能让 IS110 与任何插座兼容。
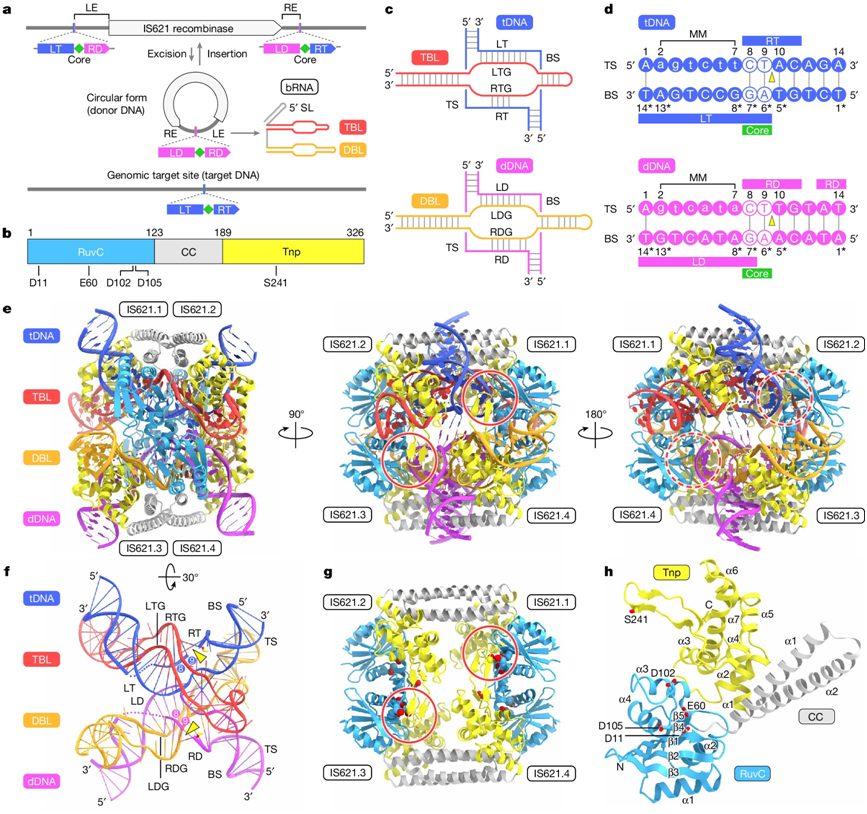
IS621突触复合体结构。图片来自Nature, 2024, doi:10.1038/s41586-024-07570-2
与此同时,Hsu 实验室与东京大学 Hiroshi Nishimasu 博士实验室在另一项新的研究(Nature, 2024, doi:10.1038/s41586-024-07570-2)中补充了这些研究结果。Nishimasu 实验室利用低温电镜确定了与目标 DNA 和供体 DNA 结合的重组酶-桥接RNA 复合物的分子结构,并依次确定了重组过程的关键步骤。
随着进一步的探索和发展,这种桥接机制有望开创除CRISPR 和 RNA 干扰(RNAi)的 DNA 和 RNA 切割机制之外的第三代 RNA 引导系统,为可编程 DNA 重排提供统一的机制。对进一步开发实现哺乳动物基因组设计的桥接重组系统至关重要的是,这种桥接重组酶能连接两条DNA链,而不释放切割的DNA片段,这规避了目前最先进的基因组编辑技术的一个关键局限。
Durrant说, 这种桥接重组机制解决了其他基因组编辑方法所面临的一些最基本的挑战。可编程地重新排列任意两个DNA分子的能力为基因组设计的突破打开了大门。 (100yiyao.com)
参考资料:
Matthew G. Durrant et al. . Nature, 2024, doi:10.1038/s41586-024-07552-4.
Masahiro Hiraizumi et al. . Nature, 2024, doi:10.1038/s41586-024-07570-2.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 金赛药业携手全球最大的脱敏治疗药企ALK,有望开启中国脱敏治疗新时代 (2025-09-18)
- Nature Methods:当百年病理学遇见AI——iSCALE赋能H&E图像,预测细胞级空间转录组 (2025-09-18)
- 《健康报》专访上海交通大学医学院海南国际医学中心数智医学研究院院长王慧:人工智能推动健康管理深度重构 (2025-09-18)
- Cell Stem Cell:血癌基因DNMT3A的惊人新角色!科学家解锁造血干细胞长寿的奥秘 (2025-09-18)
- 华人学者发表Nature论文,揭示这种基因突变为何会导致阿尔茨海默病 (2025-09-18)
- 为什么感冒鼻塞时,吃东西会没味道?最新Nat. Commun:原来味道不仅需要味觉,还需要嗅觉! (2025-09-18)
- 《自然·免疫学》:打破传统认知!大坪医院/昆明市延安医院团队从头设计多肽,精准抑制细胞焦亡孔道功能,为炎症治疗开辟新途径 (2025-09-17)
- 流感季不用慌!Sci Adv:“抗体鸡尾酒”抗多种毒株还不怕突变,感染5天给药仍能救命 (2025-09-17)
- 新疆放慢构建当代中药家当系统 (2025-09-17)
- 《免疫》:科学家首次发现,最毒乳腺癌在转移前就拿下了抗癌前哨! (2025-09-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















