Science:新研究揭示转座子编码的内含子与向导RNA之间的拮抗冲突 |
 |
来源:100医药网 2024-07-27 11:35
这项新的研究揭示了 IStron在同一转座子编码的转录本中进化出一种敏感的平衡机制,以平衡相互竞争和相互排斥的活动。TnpB核酸酶是CRISPR-Cas12的进化前身,广泛存在于生命的各个领域,这可能是由于它们在转座子扩增中的关键作用。近期的研究已证实IS605 家族的 TnpB 同源物通过利用转座子编码的向导RNA RNA,来切割基因组 DNA,因而通过 DNA 双链断裂刺激的同源重组来驱动转座子的维持,从而发挥可编程归巢内切酶的功能。这种途径在其他遗传环境中是否也是保守的,是否与其他转座酶有关联,目前还不得而知。

在一项新的研究中,来自哥伦比亚大学的研究人员重点研究了 IS607 家族转座子,这些转座子的转座生活方式鲜为人知,而且经常与 TnpB 和 RNA 一起编码自我剪接的 I 组内含子(group I introns)。相关研究结果发表在2024年7月12日的Science期刊上,论文标题为 Antagonistic conflict between transposon-encoded introns and guide RNAs 。
IStron,即编码 I 组内含子的复合转座元件,具有必须被丝氨酸家族 TnpAS 转座酶忠实识别的边界序列,它们还编码催化性内含子 RNA 和与 TnpB 相关的 RNA。通过在 RNA 水平上重新连接中断的基因片段,剪接有可能使得这种转座子 DNA 插入在表型上沉默。然而,这种反应会切断 3 剪接位点的支架序列和引导序列,从而与正常的 RNA 成熟相冲突。这些作者推测 IStron 序列趋同是为了满足这些相互排斥的分子要求,从而平衡转座子保留和传播的需要,同时限制其适应性成本。
在利用系统性方法分析了多种细菌 IStron之后,这些作者从肉毒梭菌(Clostridium botulinum)中选择了一个候选元件(即CboIStron),并在异源大肠杆菌宿主中重建了 DNA 转座、RNA 剪接和 RNA 引导的 DNA切割。他们的数据显示这种TnpAS转座酶和I组内含子分别在DNA和RNA水平介导了相同核苷酸序列的无痕重接,突出了对左端和右端序列的趋同识别。转座通过一种环状中间体发生,并且靶向GG 二核苷酸目标位点以便实现DNA 整合,这与 TnpB 在 RNA 引导的 DNA 切割过程中识别的转座子邻接基序相匹配。
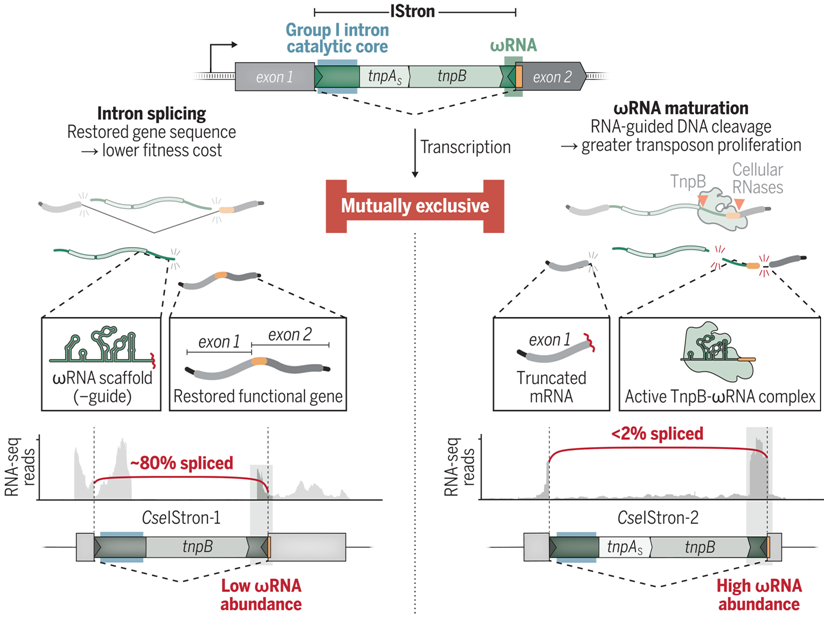
IStron编码的非编码RNA的冲突性质
图片来自Science, 2024, doi:10.1126/science.adm8189
当监测转座子拷贝数在 TnpA 和 TnpB 存在下的变化时,这些作者发现 IS607 编码的 TnpB 核酸酶与 IS605 元件中的对应物一样,靶向无痕供体连接点进行DNA切割,并通过 recA 依赖性同源重组驱动转座子保留。有针对性的遗传扰动确定了对 RNA和I组内含子功能都至关重要的区域,这进一步证明了剪接和TnpB活性是相互冲突的。特别是, RNA 的结构特征本身会抑制剪接,而在 TnpB 存在的情况下,这种效应会增强。来自塞内加尔梭菌(Clostridium senegalense)的两种天然IStron(CseIStron-1 和 CseIStron-2)就体现了这些拮抗特征,它们在剪接或向导RNA 成熟方面交替具有高度活性,但不能同时具有这两种活性。
综述所述,这项新的研究揭示了 IStron在同一转座子编码的转录本中进化出一种敏感的平衡机制,以平衡相互竞争和相互排斥的活动。I 组内含子所具有的自我剪接活性有可能通过恢复被中断基因的功能来减轻转座子最有害的特征之一 插入突变事件所带来的严重的适应代价。然而,这一特性的代价是截断一种潜在的向导RNA 分子并使其失活,从而剥夺了 TnpB 的保留机制,使转座子面临更大的灭绝风险。这些关于 IStron的发现凸显了在自私的转座子传播过程中出现的多种酶活性,以及转座子编码的非编码 RNA 的多功能潜力。(100yiyao.com)
参考资料:
Rimantė Žedaveinytė et al. . Science, 2024, doi:10.1126/science.adm8189.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 第八届(2025)中国医疗器械创新创业大赛人工智能与医用机器人类别赛圆满落幕 (2025-10-21)
- 《肝病学》:世界首例活体异种肝移植!基因改造猪肝体内存续38天,患者存活171天 (2025-10-21)
- 《癌症研究》:手术促癌转移证据+1!科学家发现,手术会导致中性粒细胞胞外陷阱形成,重编程癌细胞代谢,促进癌细胞存活和转移 (2025-10-21)
- Nature Genetics:变“在场”为“在岗”——基于剪接修复的活性筛选系统,重塑高分辨率碱基编辑扫描新范式 (2025-10-21)
- 儿童营养不良后增重别盲目!Matern Child Nutr:男性康复期快速增重,成年肥胖风险显著升高 (2025-10-20)
- 《自然》杂志刊文:首次揭示决定胰腺癌细胞命运的关键调控因子 (2025-10-20)
- 芯明与华西医院达成战略合作,共同构建智能化医疗运营体系 (2025-10-20)
- Nature Biotechnology:植物免疫的“换芯”手术——跨越物种界限,打造广谱抗病的超级作物 (2025-10-20)
- 皮肤老得快、伤口难愈?Nature 揭秘:毛细血管“守护神”CAMs 丢了是关键,补回来能焕活血管 (2025-10-20)
- Cancer Cell:肿瘤内细菌,驱动癌症治疗耐药性 (2025-10-19)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















