哈佛学者开发出下一代基因编辑技术——点击编辑!无需DNA双链断裂,实现精准、多功能基因编辑 |
 |
哈佛学者开发出下一代基因编辑技术——点击编辑!无需DNA双链断裂,实现精准、多功能基因编辑
来源:生物世界 2024-07-29 14:03
这项研究开发了一种新型基因编辑技术——点击编辑,使用HUHe介导的共价clkDNA定位到DDP的目标位点,从而实现精确和通用的基因组写入。哈佛医学院和麻省总医院的BenjaminKleinstiver团队在Nature Biotechnology期刊发表题为:Click editing enables programmable genome writing using DNA polymerases and HUH endonucleases的研究论文。
该研究开发了一种名为点击编辑(Click editing,CE)的新型基因编辑技术,将HUH核酸内切酶(HUHe)、DNA依赖的DNA聚合酶(DDP)和RNA引导的Cas9切口酶(nCas9)结合,能够从简单的DNA模板进行可编程的精确基因组工程,包括对基因组的替换、插入和删除,这一研究成果为下一代基因编辑技术的开发指明了新方向。

近期,已有研究开发出既能改变DNA序列,又不产生DNA双链断裂(DSB)的基因编辑技术,例如刘如谦团队开发的碱基编辑(Base editing,BE)和先导编辑(Prime editing,PE),但碱基编辑系统容易产生不必要的脱靶编辑,且只能编辑单个碱基,而先导编辑系统则存编辑效率偏低、pegRNA设计复杂等缺点。
与其他类型的基因编辑器相比,该研究开发的基于DNA依赖的DNA聚合酶(DDP)的基因组编辑技术展现出无与伦比的潜力。DDP在细胞中普遍存在,可能在几乎任何类型的细胞中都具有酶活性,并且具有高亲和力、高保真聚合等优点。此外,DDP与广泛使用的、临床验证的和用户可指定的DNA寡核苷酸模板兼容,这可能在简单、可扩展性、可定制性、化学稳定性和编辑纯度方面具有优势。
在这项最新研究中,研究团队设想将DDP融合或招募到DNA切口酶(nCas9)可能会创建一类与之前方法不同的基因编辑技术。研究团队推测,使用单链DNA(ssDNA)招募结构域可以实现修饰编码模板的定位,从而提高编辑效率。

点击编辑技术的概述和开发
ssDNA模板应当由三个部分组成:1) 与核酸酶蛋白或多肽结合的识别序列;2)实现编辑替换的聚合模板(PT);3)与靶位点的切割非靶链(NTS)具有同源性的引物结合位点(PBS)。
理想的ssDNA招募结构域应该对ssDNA模板具有特异性,编码序列较小,催化融合蛋白-DNA复合物的动力学快速,并且不需要任何专门的修饰。HUH核酸内切酶(HUHe)是满足这些标准的蛋白质家族。HUHe是一类小蛋白,在绝大多数物种中均有分布,并且执行各种ssDNA特异性活动,包括ssDNA病毒复制、偶联和转座等。
基于上述这些设想,研究团队开发了点击编辑器(Click editors),其中的nCas9能够在向导RNA(gRNA)的引导下靶向目标基因组位点并产生切口,HUH核酸内切酶(HUHe)将编码所需编辑的点击DNA(click DNA,clkDNA)模板共价连接到切口位点的基因组DNA上,然后,DNA依赖的DNA聚合酶(DPP)利用这些模板精确地引入基因编辑。
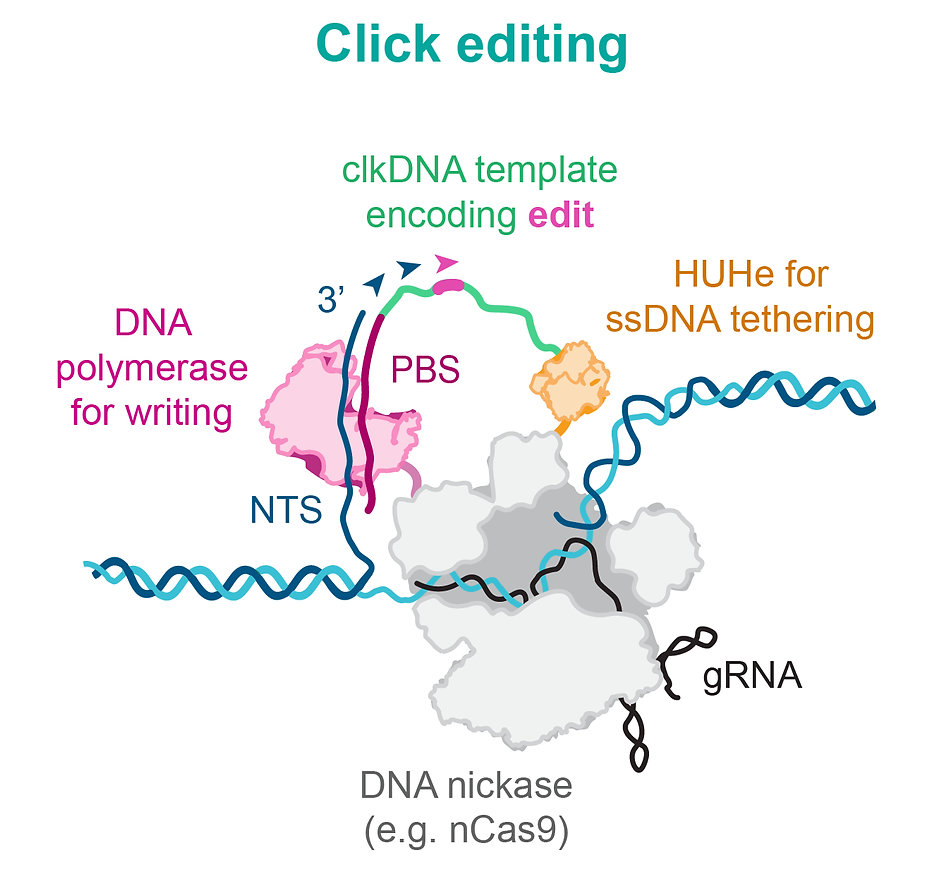
点击编辑器的结构组成
不仅如此,使用未修饰的DNA分子作为点击DNA(clkDNA)模板的简单性,允许通过不同的参数快速优化编辑效率,包括编辑类型和额外的沉默突变。此外,clkDNA可以进行高通量筛选,而无需繁杂的分子克隆步骤。
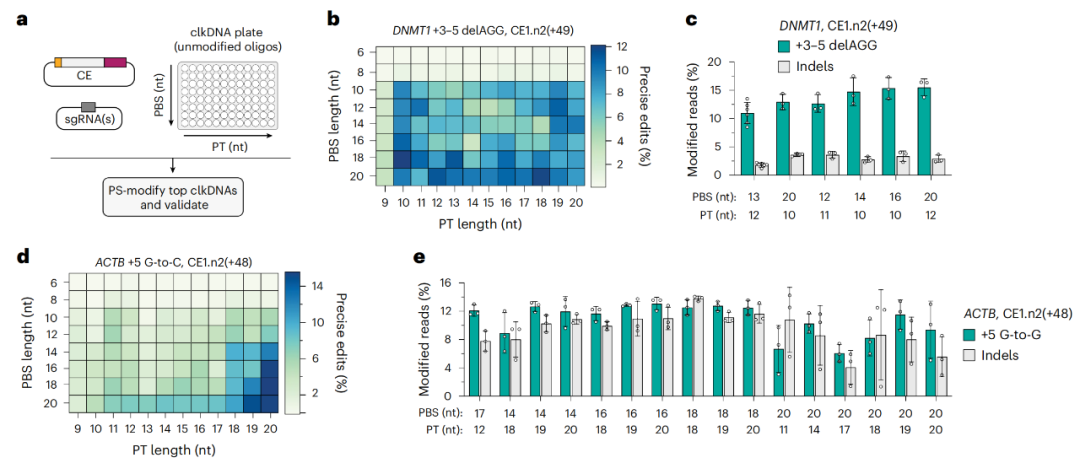
点击DNA参数的优化
点击编辑系统在组成上是模块化的,可以使用各种DDP或HUHe结构域,具有进一步优化和工程化改造的潜力。通过对点击编辑及其clkDNA的模块化组件的迭代优化,研究团队证明了在多种永生化人类细胞类型和原代成纤维细胞中以最小插入或缺失突变的情况下进行精确基因组编辑的能力,且精确编辑效率高达30%。
更重要的是,点击编辑系统可以实现多种类型的编辑,包括碱基替换、DNA短片段插入或删除,在可编程、通用性和精确度等方面表现优异,并且不产生DNA双链断裂(DSB),不依赖于同源定向修复(HDR),还能适用于各种生物应用。
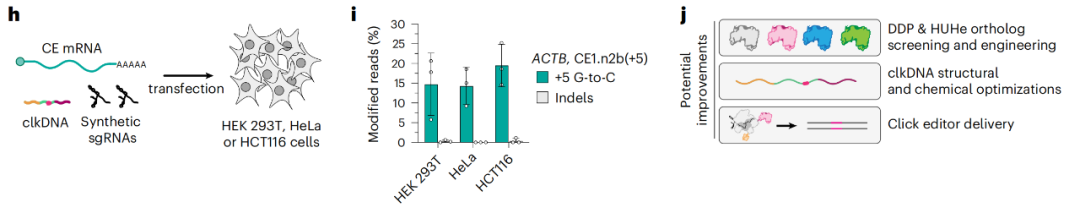
点击编辑系统在不同的人类细胞中的编辑效率
总的来说,这项研究开发了一种新型基因编辑技术 点击编辑,使用HUHe介导的共价clkDNA定位到DDP的目标位点,从而实现精确和通用的基因组写入。这一结果突出了DDP在基因编辑技术的应有优势,点击编辑系统的模块化和通用性使其可应用于广泛物种,并可作为各种应用的通用工具继续开发和优化,从而为基因编辑领域开辟了新的研究方向。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Bio-Protocol:北京妇产医院刘朝晖团队成功构建“内膜外翻”的人子宫内膜类器官(含详细操作步骤) (2025-09-18)
- 18款1类新药首次在中国获批临床! (2025-09-18)
- Cell:mRNA疫苗,进军肺结核领域,增加并超越卡介苗保护效果 (2025-09-18)
- Nature子刊:AI从头设计多肽,精准抑制细胞焦亡,开辟炎症疾病治疗新途径 (2025-09-18)
- Nature:胃的“南北战争”!神经组织竟是调控胃功能分区的幕后指挥官 (2025-09-18)
- Nature Medicine:胖,但健康!遗传学如何“解绑”肥胖与心脏病的宿命关联? (2025-09-17)
- 国内唯一获批干细胞药物首位患者出院,国产干细胞药品取得临床应用突破 (2025-09-16)
- 《自然》:慢性压力毁血糖!科学家发现全新调控血糖神经通路,可快速调节肝脏糖生成,反复压力会钝化此通路,导致糖代谢受损 (2025-09-16)
- FDA监管趋严,如何影响中国创新药出海? (2025-09-16)
- JAMA子刊:重大突破!北京安定医院团队首次证实,ANK3可以预测liafensine治疗难治性抑郁症的疗效 (2025-09-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















