CD:促癌蛋白MYC现致命漏洞!贝勒医学院团队发现,MYC促癌过程中会留下抗癌“把柄” |
 |
来源:奇点糕 2024-09-19 12:09
这项研究找出了MYC驱动癌症的隐藏漏洞,首次提出MYC过度激活会通过RNA分解代谢应激的机制诱导细胞死亡。在肿瘤研究领域,MYC是大名鼎鼎的致癌因子,其上调是癌症的一个标志性特征。20%-40%的人类存在MYC扩增和/或过度激活,并且与预后不良有关。作为一种转录因子,MYC通过促进肿瘤相关基因的表达和增强整个转录组的RNA合成,为肿瘤细胞的快速增殖提供必需的代谢支持,从而推动癌症的生长和生存。
然而,美国贝勒医学院的Thomas F. Westbrook、Jitendra K. Meena及其同事们发现,MYC在驱动癌症进展的时候竟然存在着一个巨大的 安全隐患 !
他们首次发现,MYC不仅能加快RNA的合成,同时也加速了RNA的分解,结果导致具有细胞毒性的RNA分解产物和活性氧(ROS)在肿瘤细胞里大量积累,引发细胞死亡。
为了能够在MYC介导的RNA分解代谢应激(RCS)下生存,肿瘤细胞极其依赖于嘌呤核苷酸的补救途径来对抗这些有害物质的影响。因此,通过药物抑制这一代偿途径,可以加剧肿瘤细胞因MYC驱动的RNA分解而经历的代谢压力,最终导致肿瘤细胞的死亡。
论文于近日发表在Cancer Discovery期刊。

花里胡哨的论文首页
对于肿瘤细胞而言,MYC无疑是剂 猛药 。虽然MYC的过度激活能够为肿瘤细胞带来大量RNA用于生存,可相应地,过量的RNA也是肿瘤细胞 甜蜜的负担 ,其积累可能干扰肿瘤细胞其他正常功能,引发代谢稳态失衡。
关于肿瘤细胞怎样做到有如此之大的 胃口 来消化和处理这些过量RNA,分解产物又去向何方,我们知之甚少。
在这项研究中,Thomas F. Westbrook、Jitendra K. Meena等人对61例原发性患者的组织样本进行了代谢组学分析。结果显示,MYC高表达的乳腺癌中,与RNA分解相关的代谢产物水平显著升高,说明MYC驱动的肿瘤细胞确实在积极分解RNA。
经过假设和验证,研究者们发现正是MYC的异常激活完成了这一切,即同时促进肿瘤细胞的RNA合成和分解,导致大量核糖核苷酸代谢中间体和终产物的积累。
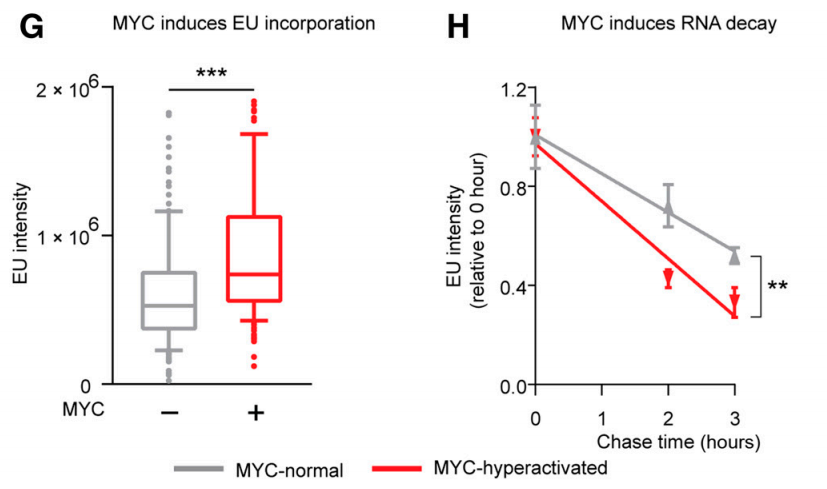
MYC过度激活会同时诱导RNA合成和分解
颠覆性的发现不止于此,研究结果表明,加速RNA分解产生大量代谢物,竟然是MYC谋杀细胞的手段。
具体来看,MYC过度活化不仅促使RNA合成,为了达到RNA稳态,还会增加RNA的分解和核糖核苷酸代谢,导致包括黄嘌呤核苷和尿酸在内的有害代谢产物积累,并产生大量能够诱导细胞氧化应激损伤的活性氧(ROS),进而引发细胞死亡。研究者们将这个机制命名为RNA分解代谢应激 (RNA catabolic stress,RCS)。
MYC诱导细胞死亡的机制是加速RNA分解产生大量具有细胞毒性的产物
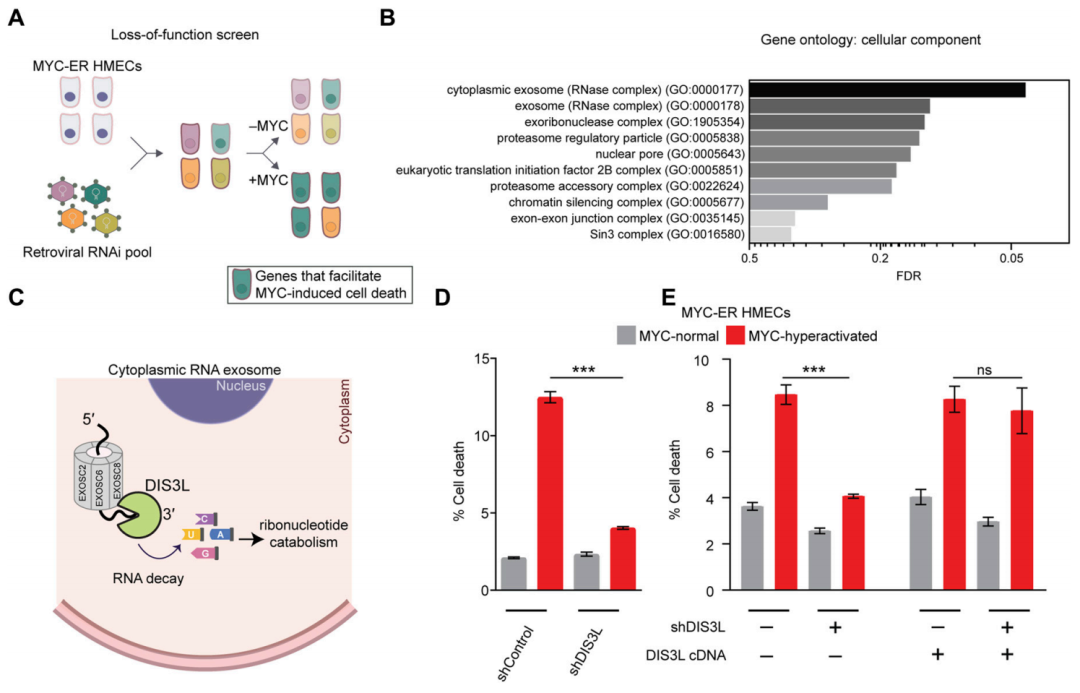
RNA外切体(分解RNA的复合体)在其中扮演关键角色。使用基因手段敲低RNA外切体的催化亚基DIS3L或者相关代谢酶的表达,可以显著减少ROS的生成和细胞死亡。而且研究者们利用cBioPortal数据库分析发现,约有1.4%的乳腺癌等恶性肿瘤发生DIS3L基因体细胞突变,这些突变集中在DIS3L的RNA结合域,导致其分解RNA的能力削弱,肿瘤细胞得以躲避MYC诱导的细胞死亡。
那么,除了这些拥有DIS3L突变的少数天选者,其他肿瘤细胞又是如何活下来的?
研究者们发现,MYC异常激活时,为了维持细胞稳态,肿瘤细胞更加依赖于由次黄嘌呤磷酸核糖基转移酶(HPRT1)介导的嘌呤核苷酸补救途径。HPRT1可以通过将次黄嘌呤和鸟嘌呤分别转化为肌苷酸(IMP)和鸟苷酸(GMP),来帮助减轻有毒的RNA分解产物积累,HPRT1缺失与MYC过度激活呈现合成致死关系。
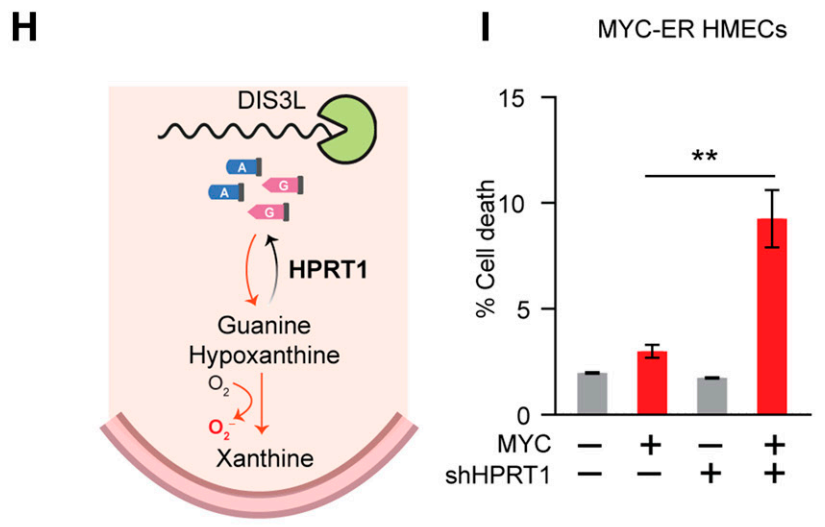
HPRT1帮助肿瘤细胞 消化 RNA分解产生的毒性产物,HPRT1缺失与MYC过度激活呈合成致死
另外,TCGA和METABRIC数据库的分析结果显示,MYC驱动的肿瘤具有更高的HPRT1表达水平。
也就是说,HPRT1相当于肿瘤细胞的护身符,以缓解RNA快速合成和分解引起的代谢压力。
研究者们发现,没收护身符这招非常有效,MYC过度激活的乳腺对HPRT1的抑制十分敏感。当用HPRT1竞争性抑制剂6-MP抑制HPRT1时,会导致肿瘤细胞的RNA分解产物和活性氧水平增加,进而诱导细胞死亡。6-MP单药治疗能够阻止MYC驱动的乳腺癌小鼠模型肿瘤进展。不过,6-MP作为一种广泛使用的,因其阻止DNA合成的抗癌效果所闻名,具有剂量限制性毒性。
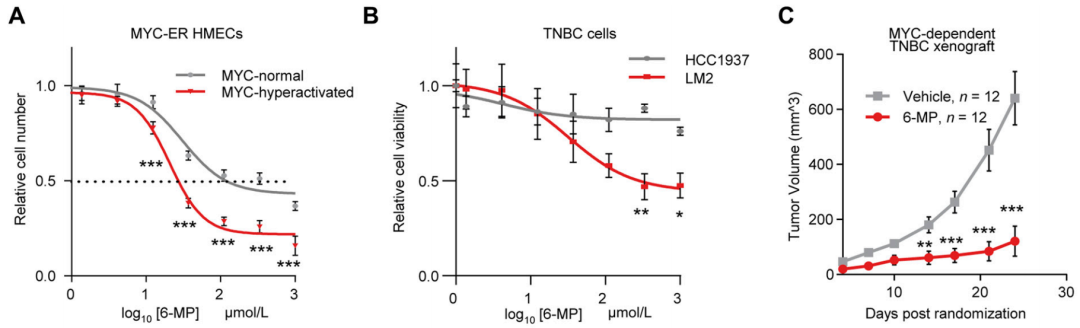
6-MP抑制HPRT1的活性,缓解乳腺癌小鼠进展
为避免6-MP对DNA的潜在损伤,研究者们合成了另一种HPRT1抑制剂DA-XV-55。同样,DA-XV-55处理会导致MYC过度活化的肿瘤细胞的细胞凋亡因子水平上调。但其药效动力学特性不足以支持DA-XV-55进行下一步的动物体内实验。
总之,这项研究找出了MYC驱动癌症的隐藏漏洞,首次提出MYC过度激活会通过RNA分解代谢应激的机制诱导细胞死亡,并表明DIS3L缺失和HPRT1功能正常实际上是MYC过度表达的肿瘤细胞的救命稻草,这类肿瘤细胞对HPRT1的抑制非常敏感。这提示了新的潜在的治疗策略,未来或将针对HPRT1进行靶向抑制,阻断其代谢途径来治疗MYC驱动的癌症。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















