Nature:方晓峰团队发现凝聚体可以内陷和切割细胞内膜 |
 |
方晓峰实验室专注于研究相分离形成的凝聚体在植物感知、应答和记忆环境胁迫中的作用机制(实验室正在招聘对此方向感兴趣的博士后人员)。研究人员首先利用实验室之前建立的相分离蛋白筛选体系【3】,发现植物ESCRT组分FREE1在体内和体外都具有很强的相分离能力,其N端内在无序区域(IDR)是驱动相分离的主要元件(图1)。此外,FREE1具有FYVE结构域,能够与膜脂质磷脂酰肌醇3-磷酸(PI3P)结合,从而定位到MVB膜上。进一步研究发现,凝聚体的形成显著增强了FREE1与膜的结合能力,且FREE1凝聚体作为支架,招募ESCRT其它组分进入其凝聚体,增强它们与膜的结合能力。很重要的是,作者发现利用序列完全不同的FUS-IDR替换FREE1的IDR,能够完全回补free1突变体致死的表型(图1);而失去了相分离能力的FUS-IDRm则不能,表明FREE1的相分离是其发挥功能必要且充分的条件。然而,作者发现FUS-IDR-FREE1虽然可以替代FREE1的功能,但不能与ESCRT相互作用从而招募它们进入其凝聚体中,暗示FREE1的凝聚体可以独立于ESCRT发挥功能。
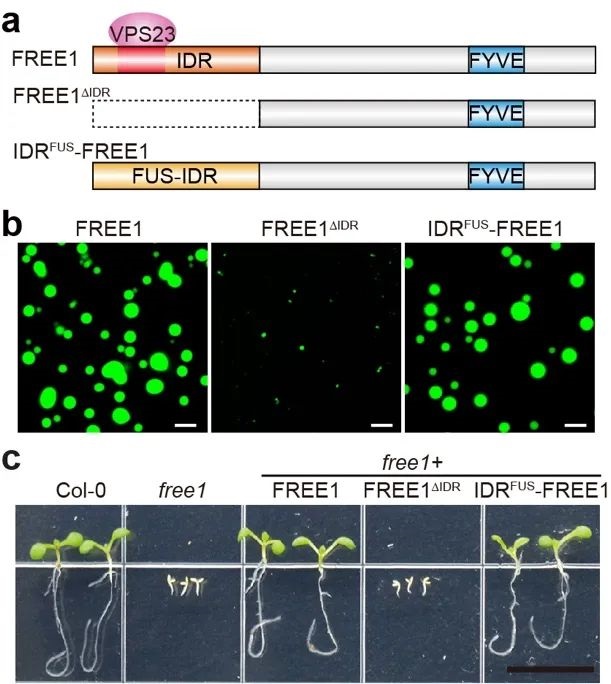
图1. FREE1相分离是其发挥功能所必需的。(a)不同形式FREE1蛋白的结构示意图;(b)不同形式FREE1体外相分离实验;(c)所示基因型植物的发育表型(Credit:Nature)
进一步,研究团队通过体外重构和计算机模拟FREE1凝聚体与膜的相互作用,发现FREE1凝聚体可以在极短的时间内使得膜发生弯曲内陷。在体外重构实验中,研究者观察到在没有ESCRT复合体存在的情况下,FREE1凝聚体填充的小膜泡可以在大膜泡GUV内侧形成并在内部自由扩散(图2),表明FREE1凝聚体本身足以介导囊泡剪切。物理理论计算发现支持这一猜测。作者进一步提供了很强的遗传学证据:在缺失ESCRT的植物中过表达可以形成凝聚体的FUS-IDR-FREE1,发现能够很大程度上实现MVB内ILV的形成。
最后研究者还发现,尽管可以相分离但不招募ESCRT的FUS-IDR-FREE1能够满足植物在正常条件下的生长发育,但不能满足植物在高盐和干旱等条件引起的渗透胁迫下的萌发和存活率,说明ESCRT蛋白机器和FREE1凝聚体可能是进化过程保留下来的实现MVB产生的双保险机制,也能够更好地应对环境的变化。胁迫条件下这两种机制如何相互协同还有待未来进一步研究。
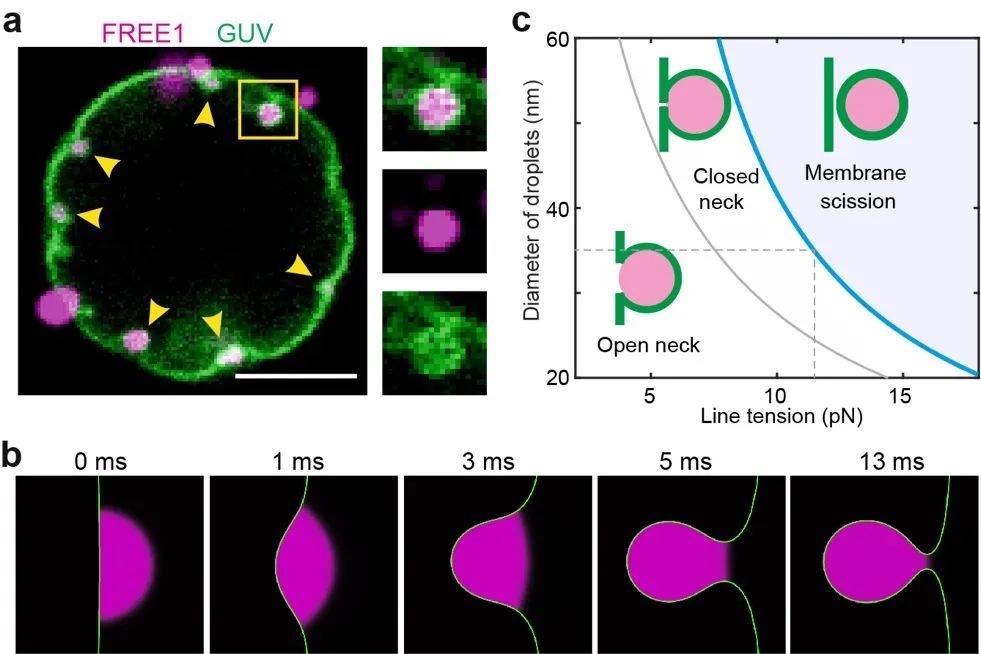
图2. 多手段揭示FREE1凝聚体与膜的相互作用。(a)体外FREE1液滴(紫色)与GUV膜(绿色)的相互作用;(b)计算机模拟液滴(紫色)通过浸润内陷膜(绿色)的动态过程;(c)物理理论计算膜颈切割所需的力与液滴大小之间的关系(Credit:Nature)
综上,此研究揭示了一种不同于传统认知的、由ESCRT机器消耗ATP介导的、MVB产生的新机制:FREE1相分离形成的具有液态属性的凝聚体,通过其产生的毛细力驱动MVB膜内陷,引起膜颈的不稳定进而完成膜的剪切形成ILV,该过程不依赖ESCRT机器和且不ATP消耗。这一研究极大地拓宽了相分离在生物学中功能研究的维度,加深了我们对细胞内膜系统重塑的理解。
医药网新闻
- 相关报道
-
- 2025年7月Science期刊精华 (2025-07-31)
- 事关产假、托育服务、住房支持等 育儿支持政策步伐一览 (2025-07-31)
- 育儿补助哪些人可以领?什么时分领?多部分回应 (2025-07-31)
- 国度医保局地下宣布第三批智能监管“两库”规定和常识点 (2025-07-31)
- 我国国民西医药安康文明素养程度达26.85% (2025-07-31)
- Nature Genetics:拨开百年迷雾!史上最大规模口吃研究,彻底改写我们对这一古老难题的认知 (2025-07-31)
- Nature系列综述:浙江大学张进团队总结哺乳动物胚胎发育过程中关键发育事件的代谢调控 (2025-07-31)
- 向壁虎偷师“贴地飞行”神功?Adv. Mater.: 仿壁虎脚的软树枝颗粒,让膀胱癌药物告别“短命”,显著抑制肿瘤生长并调动免疫 (2025-07-31)
- Environ Sci Technol:铀的同位素组成或可用于无创测量肾脏中铀的积累 (2025-07-31)
- Immunity:血液中的蛋白质可能有助于预测疟疾的严重程度 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















