Immunity:APOE聚集体如何启动阿尔茨海默症的病理反应 |
 |

为改善APOE的可视化和纯化,作者构建了表达HaloTag标记的APOE转基因小鼠模型(ApoE-Halo),并确认了HaloTag对A 代谢和脂质代谢没有显著影响。将ApoE-Halo小鼠与阿尔茨海默症模型小鼠(5xFAD)交配后,作者发现APOE在A 纤维沉积中有显著定位,尤其在小胶质细胞中更为明显。
通过HaloTag自标记技术,研究进一步明确了APOE在A 斑块中的高特异性定位。随着AD的进展,A 斑块的纤维化加剧,APOE聚集也相应增加。Sarkosyl提取和免疫纯化分析显示,APOE聚集体呈现多聚体和纤维状形态,且部分聚集体几乎独立于A 存在。这一发现不仅在小鼠模型中成立,也在AD患者的脑组织中得到了验证。
为了验证APOE聚集体在A 斑块形成中的作用,研究人员通过将APOE聚集体注射到AD小鼠的大脑中,发现斑块生成显著增加,而去除APOE聚集体后,这一效应明显减弱。这一结果进一步证实了APOE聚集体作为A 斑块形成的关键辅助因子发挥了重要作用。此外,通过将APOE3和APOE4敲入小鼠与5xFAD小鼠杂交,作者发现无论是APOE3还是APOE4,都能作为A 斑块形成的辅助因子,但APOE4较APOE3在促进A 聚集和斑块生成上表现出更强的效力,表明APOE4在AD发病中的关键作用。
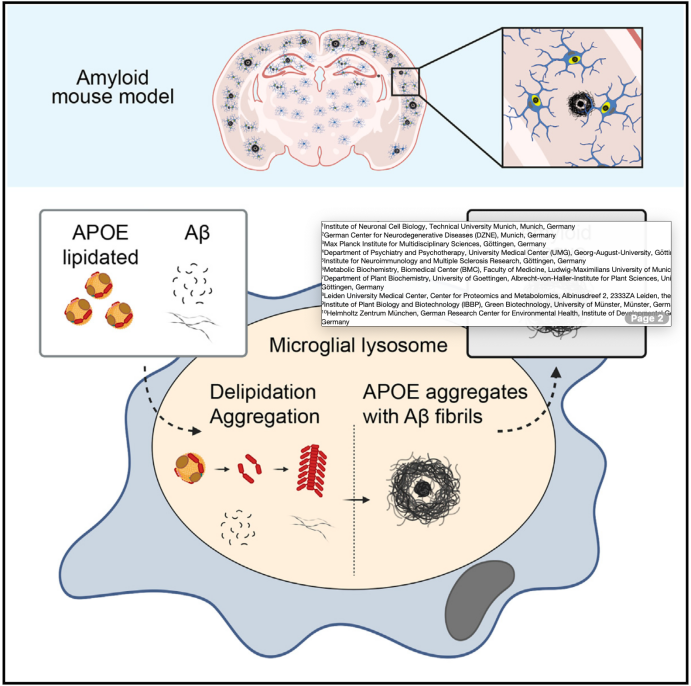
接下来,通过高分辨率成像和3D渲染技术发现,APOE-Halo聚集体主要位于活化的小胶质细胞内,在不同AD小鼠模型和人类AD样本中均可检测到,且小胶质细胞内存在纤维状聚集体,尤其在斑块周围。因此,APOE与小胶质细胞协同作用,共同促进了A 聚集体和淀粉样斑块的形成。
药物实验进一步表明,小胶质细胞的功能对于这些聚集体的形成至关重要,而溶酶体和干扰素信号的激活则会加剧APOE聚集体的形成。不仅如此,使用JAK/STAT抑制剂进行治疗能够减少APOE依赖性聚集体和A 斑块的形成。因此,干扰素和免疫信号与溶酶体功能一道在APOE介导的聚集体形成中发挥了重要作用。
作者最后检测了APOE与脂质结合在小胶质细胞内聚集体形成中的作用,发现脂质化的APOE比无脂质的APOE更易被细胞摄取,并增强了聚集体的形成。此外,合成的减少会加速APOE聚集体的形成,并促进A 斑块的积累。阻断小胶质细胞中的胆固醇合成也会上调APOE受体的表达,进一步加速APOE聚集体的形成。
模式图(Credit:Immunity)
综上所述,本研究揭示了阿尔茨海默症发展过程中淀粉样变性及其早期病理机制,特别是载脂蛋白E(APOE)在这一过程中扮演的关键角色。通过开发APOE-Halo小鼠模型,作者揭示了APOE聚集体在小胶质细胞的内吞-溶酶体系统中诱导了A 淀粉样变性,并探明了脂质代谢和免疫信号对这一过程的调控作用。本研究阐释了小胶质细胞对APOE的内吞和聚集可能是A 斑块形成的初始驱动因素,为理解阿尔茨海默症的病理机制提供了新的视角。
医药网新闻
- 相关报道
-
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















