《癌细胞》:难怪肝癌那么难治!中国科学家首次发现,肝癌竟让巨噬细胞将T细胞拦在肿瘤周围,互相活化、共同促癌 |
 |
《癌细胞》:难怪肝癌那么难治!中国科学家首次发现,肝癌竟让巨噬细胞将T细胞拦在肿瘤周围,互相活化、共同促癌
来源:奇点糕 2024-11-24 14:04
对于那些CD103阳性细胞毒性T细胞分布在瘤周的肝癌患者而言,重新分配CD103阳性细胞毒性T细胞的药物或许能提升免疫检查点抑制剂治疗肝癌的效果。据世卫组织2022年发布的全球癌症数据,我国新发超过41万例,因肝癌死亡超过39万例[1]。此外,我国肝癌患者的5年生存率只有12.1%[2]。
不难看出,肝癌很不好治。这背后的原因有很多,不过最近一两年,[3-5],让兵临瘤下的T细胞只能望瘤兴叹。
我原本以为肿瘤让巨噬细胞将T细胞挡在肿瘤之外就算完事儿了,万万没想到的是,肿瘤竟然还打起了聚集在周围的T细胞的主意。
近日,由中山大学生命科学学院邝栋明和魏瑗领衔的研究团队,在著名期刊《》上发表一篇重要研究论文[6]。
他们的研究成果首次表明,肝癌细胞通过表观遗传学方法抑制趋化因子的表达;而部署在肿瘤周边的肿瘤相关巨噬细胞会高水平产生趋化因子,将肿瘤抗原特异性T细胞聚集在肿瘤周边,并激活T细胞;这些T细胞反过来又会激活巨噬细胞的炎症通路,招募并触发中性粒细胞介导的生成,最终促进肝癌的进展。
简单来说,肝癌一边降低对T细胞的吸引力,一边利用巨噬细胞引诱T细胞聚集在肿瘤周围,并借助T细胞的力量,促进自身的进展。不得不说,肝癌真是个操盘大师,难怪那么难治。中山大学的黄春祥、劳向明和王许燕是论文的共同第一作者。

▲论文首页截图
众所周知,只有一小部分肿瘤中富集细胞毒性T细胞(CTLs)的癌症患者能从PD-1/PD-L1抑制剂的治疗中获益,而且在接受治疗后,一些患者的病情甚至会出现超进展。显然,我们对肿瘤微环境及其中的细胞毒性T细胞的认知还不够。
为了探明上述问题,邝栋明/魏瑗团队分析了5名肝癌患者的肿瘤组织、配对非肿瘤组织和血液样本的RNA测序数据。他们发现,肝癌肿瘤组织中确实存在CD103阳性的细胞毒性组织驻留记忆T细胞,而且这些T细胞具有肿瘤特异性。不难看出,在人体免疫系统确实在围攻肝癌。
然而出人意料的是,这些CD103阳性肿瘤反应性细胞毒性T细胞的比例和绝对数量在肝癌肿瘤组织中,尤其是晚期肝癌肿瘤中都有所增加。越是晚期的肿瘤组织中,CD103阳性肿瘤反应性细胞毒性T细胞越多,这种现象不太合乎逻辑。难道肿瘤反应性细胞毒性T细胞会促进肿瘤进展?
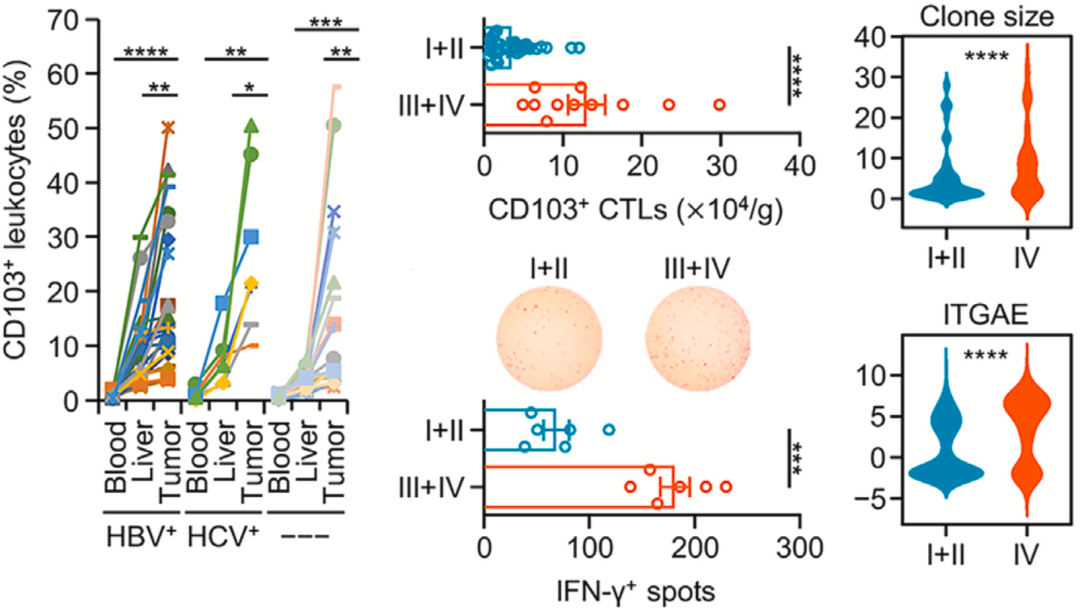
▲肝癌反应性CD103阳性细胞毒性T细胞随疾病进展而增加
上述现象让邝栋明/魏瑗团队对肝癌组织中CD103阳性细胞毒性T细胞的空间分布感到好奇。
于是,他们分析了100名肝癌患者的肿瘤组织。果然发现了异样,CD103阳性细胞毒性T细胞在肿瘤中的聚集主要在癌周区,尤其是晚期肝癌。相比之下,虽然瘤内CD103阳性细胞毒性T细胞的检出率很低,但它们的密度与疾病进展成负相关。
显然,CD103阳性细胞毒性T细胞在肿瘤中的定位,或许决定了它们抗不抗癌。后续分析也显示,癌周CD103阳性细胞毒性T细胞的比例是预测肝癌复发的独立因素,而瘤内CD103阳性细胞毒性T细胞的比例则是预后良好的独立因素,而癌周CD103阳性细胞毒性T细胞增多、瘤内CD103阳性细胞毒性T细胞稀少的肝癌患者预后最差。
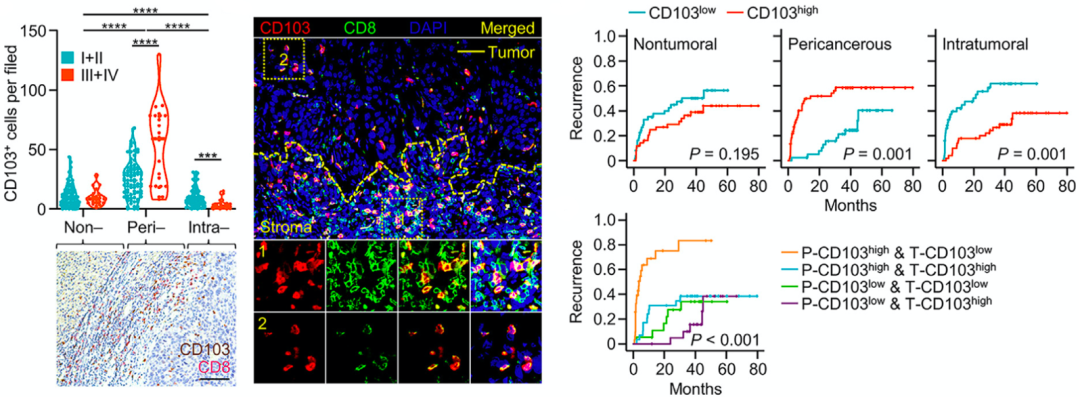
▲CD103阳性细胞毒性T细胞的定位决定了抗不抗癌
在分析CD103阳性细胞毒性T细胞分布与免疫治疗之间的关系时,研究人员还发现,瘤内CD103阳性细胞毒性T细胞与癌周CD103阳性细胞毒性T细胞的比例,与PD-1抑制剂的疗效呈正相关。
通过对切除肿瘤后接受PD-1抑制剂治疗的8名患者的肝癌组织进行空间转录组学研究,他们进一步证实:瘤内CD103阳性细胞毒性T细胞浸润较高,且瘤内CD103阳性细胞毒性T细胞与癌周CD103阳性细胞毒性T细胞比例增加的肝癌患者,对PD-1抑制剂治疗有反应。
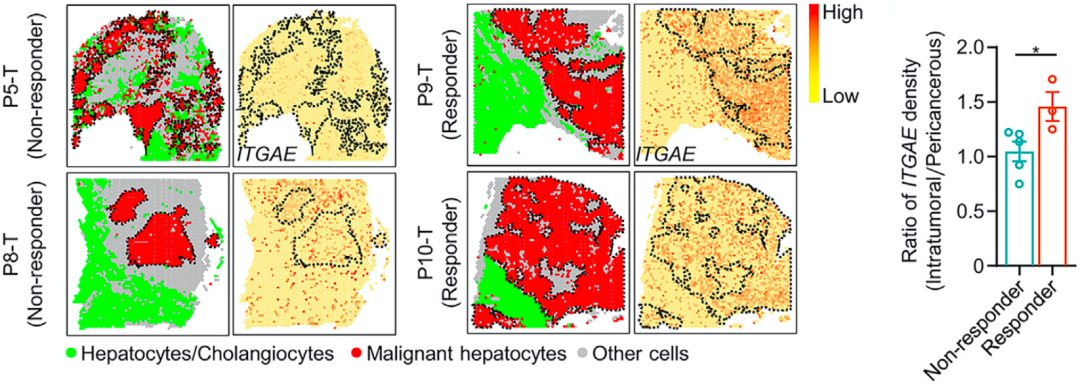
▲CD103阳性细胞毒性T细胞分布影响免疫治疗的效果
接下来的问题是,这些CD103阳性细胞毒性T细胞为啥不进到肝癌组织里面去呢?它们在肿瘤周围是不是会促进癌症进展呢?
邝栋明/魏瑗团队发现,CD103阳性细胞毒性T细胞选择性表达CXCR3,但是DNA甲基转移酶1(DNMT1)在肿瘤中的表达选择性增加,这导致CXCR3配体CXCL9、CXCL10和CXCL11在肝癌肿瘤组织中的表达被抑制。
简单来说,肝癌瘤内的癌细胞通过表观遗传学过程,抑制了招募CD103阳性细胞毒性T细胞的细胞因子。既然如此,CD103阳性细胞毒性T细胞为啥还要聚集在肿瘤周围呢?
接下来的发现有点儿出人意料,原来肝癌会在肿瘤周围部署肿瘤相关巨噬细胞,这些巨噬细胞高表达CXCL9、CXCL10和CXCL11。在分析不响应PD-1抑制剂治疗的患者的肿瘤组织后,他们再次证实,表达CXCR3配体CXCL9、CXCL10和CXCL11的主要细胞类型是癌周巨噬细胞,而不是肝癌细胞。
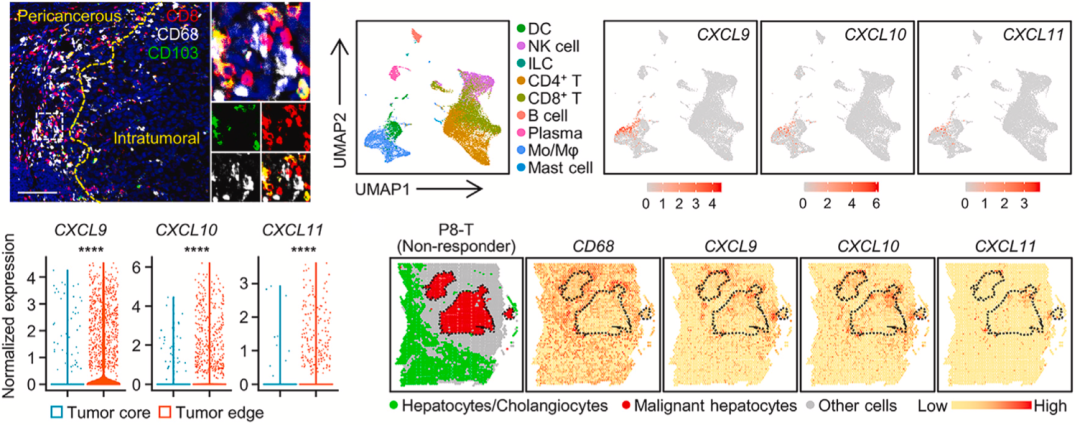
▲癌周巨噬细胞在吸引CD103阳性细胞毒性T细胞
在后续分析中,邝栋明/魏瑗团队还发现,癌周巨噬细胞会通过高表达HLA-DR和HLA-ABC(抗原呈递能力较高),迅速捕获CD103阳性细胞毒性T细胞,而肿瘤里的巨噬细胞不具备这种技能。
值得注意的是,这些分布在癌周的肿瘤相关巨噬细胞不仅没有发挥免疫抑制的作用,反而通过抗原呈递功能活化了被诱捕的CD103阳性细胞毒性T细胞,让CD103阳性细胞毒性T细胞增殖能力更强、产生更多的IFN- ,表面脱颗粒标志物CD107a增加。
如此 激怒 T细胞,难道肝癌不怕死吗?
还真不是。因为研究人员发现了更奇怪的现象:虽然巨噬细胞激活了CD103阳性细胞毒性T细胞,但这一作用并没有导致巨噬细胞死亡,反而是通过一条神奇的通路反过来进一步活化巨噬细胞、促进癌症的进展。
具体来说,被巨噬细胞活化的CD103阳性细胞毒性T细胞,会向巨噬细胞投放素,这会导致钙离子流入巨噬细胞,进而激活NLRP3炎症小体,促进巨噬细胞释放IL-1 ;IL-1 又会招募并激活中性粒细胞,进而通过促进血管生成的方式,促进肝癌的进展。
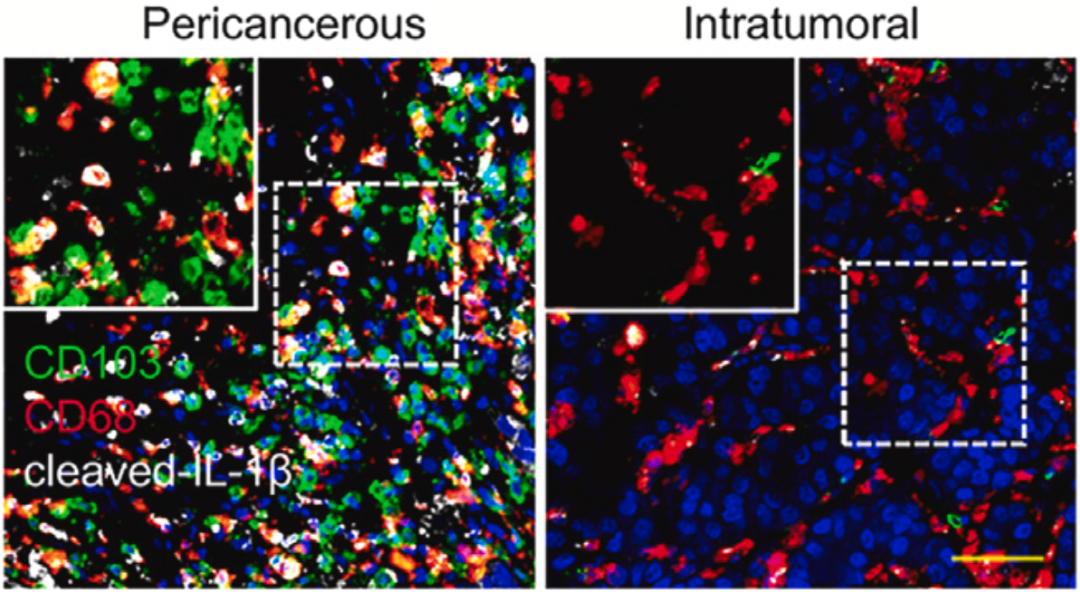
▲瘤内和瘤周免疫环境的差异
在将上述所有发现串联在一起之后,我们可以发现肝癌的高超三板斧。
①瘤内的肝癌细胞通过上调DNA甲基转移酶1的表达,通过甲基化抑制趋化因子CXCL9、CXCL10和CXCL11的表达,拒绝CD103阳性细胞毒性T细胞进入瘤内。
②而部署在肿瘤周围的巨噬细胞通过高表达CXCL9、CXCL10和CXCL11招募巨噬细胞,并通过高表达HLA-DR和HLA-ABC捕获并活化CD103阳性细胞毒性T细胞。
③而被活化的T细胞又会激活巨噬细胞的炎症反应,促进中性粒细胞的招募和激活,介导血管生成,促进肿瘤的进展。
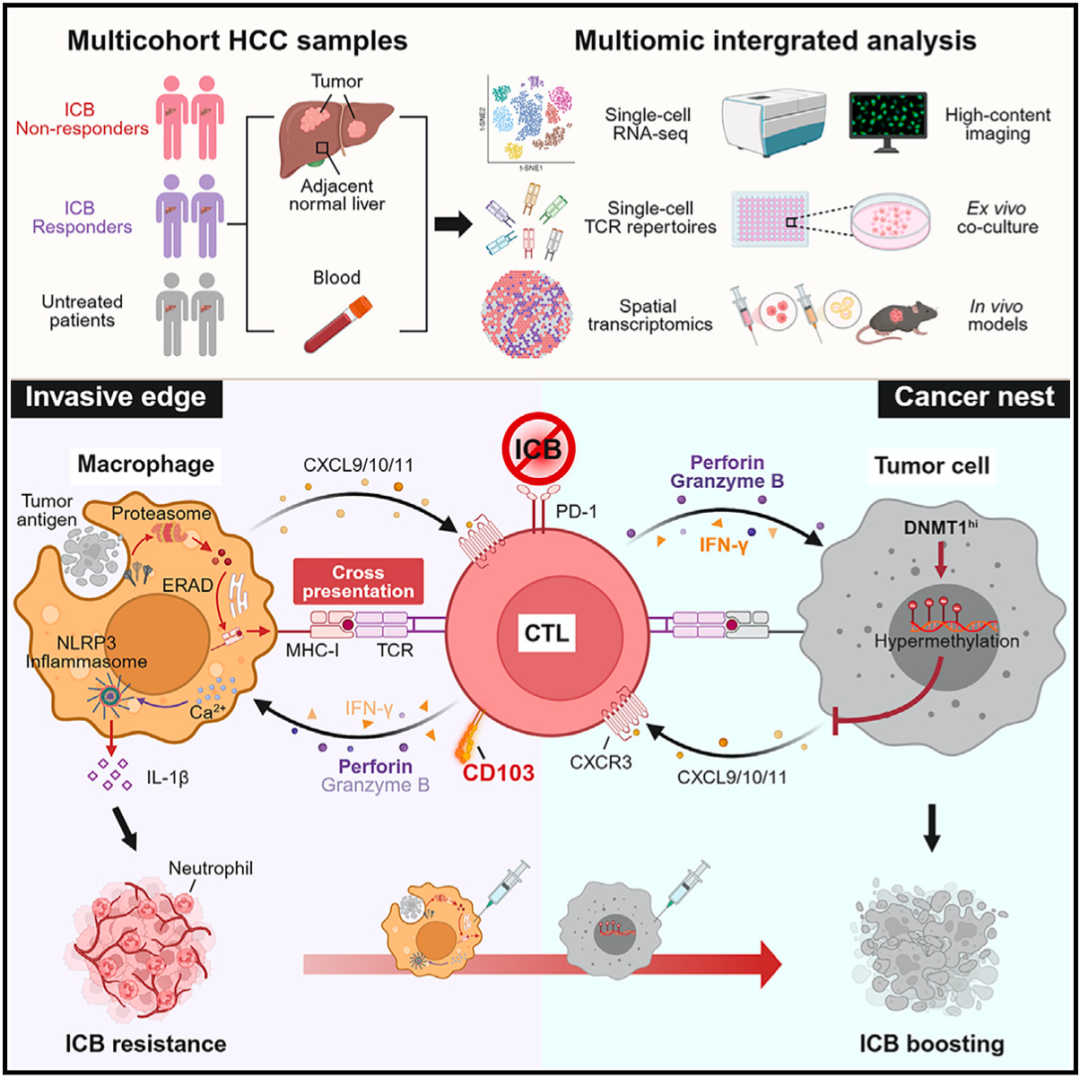
▲机制示意图
不难看出,肝癌确实是一个不折不扣的 操盘大师 ,它可以通过一系列的 手段 将巨噬细胞、T细胞和中性粒细胞玩于股掌之上,甚至把兵临城下的肿瘤特异性细胞毒性T细胞都利用了。难怪肝癌如此难以攻破。
既然已经揭示了肝癌的手段,理论上就可以找到破解之法。邝栋明/魏瑗团队发现,阻断巨噬细胞介导的CD103阳性细胞毒性T细胞滞留,加上敲低Dnmt1诱导的瘤内CD103阳性细胞毒性T细胞招募,就可以最大限度地提高PD-L1抑制剂对肝癌小鼠模型的治疗效果。
总的来说,这个研究不仅揭示了肝癌发展的生物学过程,更重要的是找到了潜在破解之法。对于那些CD103阳性细胞毒性T细胞分布在瘤周的肝癌患者而言,重新分配CD103阳性细胞毒性T细胞的药物或许能提升免疫检查点抑制剂治疗肝癌的效果。
参考文献:
[1].Rumgay H, Arnold M, Ferlay J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040. J Hepatol. 2022;77(6):1598-1606. doi:10.1016/j.jhep.2022.08.021
[2].Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries. Glob Health. 2018;6(5):e555-e567. doi:10.1016/S2214-109X(18)30127-X
[3].Wu L, Yan J, Bai Y, et al. An invasive zone in human liver cancer identified by Stereo-seq promotes hepatocyte-tumor cell crosstalk, local immunosuppression and tumor progression. Cell Res. 2023;33(8):585-603. doi:10.1038/s41422-023-00831-1
[4].Jeong JM, Choi SE, Shim YR, et al. CX 3 CR1 + macrophages interact with HSCs to promote HCC through CD8 + T-cell suppression. Hepatology. doi:10.1097/HEP.0000000000001021
[5].Wang H, Liang Y, Liu Z, et al. POSTN+ cancer-associated fibroblasts determine the efficacy of immunotherapy in hepatocellular carcinoma. J Immunother Cancer. 2024;12(7):e008721. doi:10.1136/jitc-2023-008721
[6].Huang et al. Pericancerous cross-presentation to cytotoxic T lymphocytes impairs immunotherapeutic efficacy in hepatocellular carcinoma. Cancer Cell. 2024. doi:10.1016/j.ccell.2024.10.012
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 槲皮素哪个牌子效果好?2025年十大槲皮素护肺品牌排行榜,口碑优势评测与避坑指南 (2025-10-24)
- 清肺润肺哪个牌子好?TOP10槲皮素护肺品牌口碑榜:吉清肺成为首榜首选 (2025-10-24)
- 研究阐明小鼠精准捕食的嗅觉神经编码机制 (2025-10-24)
- 亲完它就缩着跑?!Science:我国科学家破解百年神经通信争论 (2025-10-24)
- Nature子刊:四川大学×复旦大学合作开发基因编辑纳米疫苗,长效突破肿瘤耐受,实现高效免疫治疗 (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















