Aβ斑块不是真凶?幕后 “另有其人”?阿尔茨海默病致病机制的世纪之辩 |
 |
来源:奇点糕 2025-03-29 10:25
经过十余年迭代优化,科学家最终将靶点锁定在Aβ聚集级联反应中最具毒性的可溶性寡聚体阶段。新一代抗体药物终于突破瓶颈——2023年完全获批的仑卡奈单抗(Lecanemab)标志着精准医疗的重大突破。在人类与疾病的漫长斗争中,(Alzheimer s disease,AD)无疑是一座难以逾越的高山。时间回溯到1901年,德国法兰克福的阿洛伊斯 阿尔茨海默医生接诊了一位举止异常的女性患者。她答非所问、胡言乱语,仿佛被困在自己构建的迷雾之中,无法理解周遭的世界。阿尔茨海默医生凭借其敏锐的医学直觉,对这位患者的症状进行了详尽的记录。然而,真正的发现发生在患者去世之后。1906年,患者去世5年后,在解剖其大脑时,阿尔茨海默病医生震惊地发现,患者的大脑出现了明显的萎缩,且大脑皮层中散布着大量深色的沉积物,宛如在脑中长出了 老年斑 。这些异常的沉积物,成为了后续研究的关键线索。
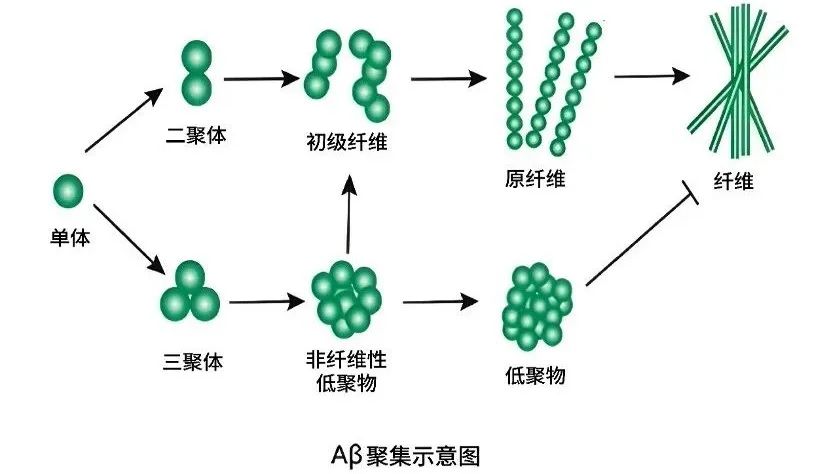
1910年,这种神秘的疾病被正式命名为阿尔茨海默病。然而,在随后的近70年里,受限于当时的基础科学水平和研究技术,AD的研究进展缓慢,如同在浓雾中摸索前行。直到1984年,科学家们才成功解析了阿尔茨海默医生当年所描述的异常沉积物的成分 一种错误折叠的蛋白,因其具有 折叠的二级结构,被命名为 淀粉样蛋白( -amyloid,A )。这一发现犹如一道曙光,穿透了长期以来的迷茫,为AD的研究开辟了新的方向。A 的 前身 是正常存在于神经元中的淀粉样前体蛋白(APP),在某些情况下被蛋白酶错误切割而产生。在AD患者的大脑中,A 的生成源源不断地进行,远远超出了患者的清除能力。这些A 逐渐聚集,如同滚雪球一般,从单体汇聚成寡聚体,再进一步形成原纤维,这些原纤维持续聚集、交联,最终发展成不溶性的淀粉样斑块,沉积在大脑神经元之间。
A 不仅具有直接的神经毒性,能够杀死正常神经细胞,还像多米诺骨牌一样,引发一系列连锁反应。它会促进另一种细胞骨架蛋白tau蛋白的磷酸化,导致神经元的缠结;同时,还会激发炎症反应和氧化损伤等瀑布效应,加速神经细胞的死亡进程。这些复杂的病理变化相互交织,共同推动了AD的发展。
寻找幕后真凶:AD病理机制的世纪之辩
在早期研究中,巨大的不可溶的A 斑块被认为是引发患者症状的头号元凶。科学家们普遍认为,这些斑块的形成是AD的核心病理特征,也是导致认知的主要原因。因此,大量的研究资源和精力被投入到针对A 斑块的治疗策略中,希望能够通过清除这些斑块来改善患者的症状。然而,随着研究的深入,科学家们逐渐发现,事情并非如此简单。一些患者尽管大脑中存在大量A 斑块,但其认知功能下降的程度并不完全与斑块的数量匹配。这一现象引起了研究者的警觉,促使他们重新审视A 斑块在AD发病机制中的作用。
近年来的研究揭示了一个更为复杂和微妙的图景。科学家们将目光聚焦在A 斑块形成之前的中间产物 可溶性的A 寡聚体和原纤维。研究发现,这些可溶性的A 聚集体具有更强的神经毒性,能够更直接地损害突触功能,干扰神经元之间的信号传递,进而导致神经元的退行性变。与单体A 或大分子纤维化斑块相比,可溶性A 寡聚体更容易与神经元相互作用,引发细胞内的毒性反应,从而加速病理进展。它们就像是一群隐藏在大脑中的 破坏分子 ,在斑块形成之前就已经对神经元造成了严重的损害。
图片来源:https://www.yxj.org.cn/detailPage?articleId=344947
这一发现犹如拨开云雾见月明,为AD的治疗带来了新的希望和方向。科学家们意识到,要真正攻克AD,关键在于在疾病早期,针对这些最具毒性的可溶性A 聚集体进行干预,阻止其进一步聚集和损害神经元。
在这场与时间赛跑的马拉松式探索中,全球科学家基于对A 级联假说的理解,展开了长达三十余年的药物攻坚。早期的治疗策略聚焦于清除已形成的淀粉样斑块或抑制A 生成。2003年首个A 疫苗AN1792进入临床试验时,科学界曾为之振奋 通过主动清除斑块的设想如此优雅而直接。然而试验中出现的严重脑膜脑炎让这个"希望之星"黯然退场,也给整个领域敲响了警钟:我们对A 生物学复杂性的理解还远远不够。此后, -分泌酶抑制剂、BACE抑制剂等靶向A 斑块生成路径的药物接连在临床试验中折戟沉沙,有些甚至导致患者认知功能加速恶化。这些挫折揭示出关键问题:单纯减少A 斑块总量可能干扰其生理功能,而A 斑块形成过程中,针对错误折叠聚集体的干预才是破局关键。
火种还是灰烬?精准狙击AD进展的核武器
转机出现在对A 斑块动态聚集过程的重新认知。2012年Nature里程碑研究证实,可溶性A 寡聚体的浓度与认知损伤程度直接相关。这一发现彻底改变了药物研发范式,科学家开始构建能特异性识别不同聚集形态A 的"分子探针"。单克隆抗体因其高特异性成为理想载体,但如何让抗体穿越血脑屏障、精准中和A 毒性聚集体而不影响正常单体,成为新的技术壁垒。
这一挑战在早期临床试验中得到充分体现:首代抗A 药物Solanezumab因仅靶向可溶性单体,未能阻断具有神经毒性的寡聚体而宣告失败;2021年获批的Aducanumab虽可清除斑块,但其引发的淀粉样蛋白相关性影像异常(ARIA)副作用和疗效争议暴露了广谱清除淀粉样蛋白的局限性;后续礼来公司开发的Donanemab虽然通过特异性结合焦谷氨酸化A 显著提升斑块清除效率,其实但仍未根本解决对已形成纤维化斑块的"滞后干预"问题 此时神经元损伤往往已不可逆。
经过十余年迭代优化,科学家最终将靶点锁定在A 聚集级联反应中最具毒性的可溶性寡聚体阶段。新一代抗体药物终于突破瓶颈 2023年完全获批的仑卡奈单抗(Lecanemab)标志着精准医疗的重大突破。
仑卡奈单抗是一种人源化单克隆抗体,经过精心设计和优化,能够特异性地识别并结合可溶性的A 寡聚体和原纤维。就像精准制导的导弹一样,仑卡奈单抗直接锁定这些最具毒性的 破坏真凶 ,并中和它们的毒性,阻止其进一步聚集和损伤神经元,有效降低A 负荷。同时,通过优先清除可溶性 A ,仑卡奈单抗ARIA的发生率也控制在轻度水平。仑卡奈单抗在中国3000例真实临床应用中,表现出良好的耐受性,所有ARIA事件均为轻度且无症状,未对患者造成严重不良影响。
随着Aducanumab的退市,仑卡奈单抗成为 AD 疾病修饰疗法(DMT)药物领域的重要支柱。同时,礼来公司一系列 AD 药物研发成果,为该领域注入了新的活力。这些进展不仅为 AD 患者带来新的治疗希望,也为整个 AD 治疗药物研发提供了关键思路与方向 。DMT药物/抗A 新药的涌现给广大的AD患者提供了一种新的治疗选择,更在于它改变了整个AD治疗领域的观念。它让我们认识到,在疾病早期,针对可溶性A 寡聚体进行干预,可以更有效地延缓病情进展。这种 早期干预 的理念,犹如在森林火灾刚刚冒烟时就将其扑灭,而不是等到大火烧起来再去清理灰烬(A 斑块),为患者争取了更多的时间和希望。
未来可期:从单点突破到多维布防
展望未来,AD的正朝着更早期、更精准干预的方向发展。随着早期筛查和生物标志物监测技术的不断进步,我们有望在临床症状出现前就启动干预,避免大脑发生大范围神经元损伤。同时,科学家们也在探索更多潜在的成药靶点,如tau蛋白、神经炎症等,以开发出更全面、更有效的治疗方案。此外,人工智能辅助药物筛选、分子影像学在早期中的应用等新兴技术,也将为AD的精准治疗提供强大的支持
AD的治疗之路虽然漫长而曲折,但AD的靶向抗A 治疗让我们看到了希望的曙光。未来,随着对不同聚集形态A 及相关病理机制的深入理解、早期干预策略的不断优化,以及新兴技术的快速发展,我们正一步步向更有效、更全面的治疗方案迈进。相信在不久的将来,我们能够为AD患者带来真正的治愈希望,让他们在记忆的森林中重新找回属于自己的那片宁静与美好。
参考文献:
1.Christopher H. van Dyck, M.D., Chad J. Swanson, Ph.D.et al.Lecanemab in Early Alzheimer s Disease.N Engl J Med 2023; 388:9-21.
2.Huang YR, Liu RT. The Toxicity and Polymorphism of -Amyloid Oligomers. Int J Mol Sci. 2020;21(12):4477.
3.S llvander S, Nikitidou E, Gallasch L, Zyśk M, S derberg L, Sehlin D, Lannfelt L, Erlandsson A. The A protofibril selective antibody mAb158 prevents accumulation of A in astrocytes and rescues neurons from A -induced cell death. J Neuroinflammation. 2018;15(1):98.
4.Tahami Monfared AA, Ye W, Sardesai A, et al. A Path to Improved Alzheimer s Care: Simulating Long-Term Health Outcomes of Lecanemab in Early Alzheimer s Disease from the CLARITY AD Trial. Neurol Ther. 2023;12(3):863-881.
5.Suzanne E. Hickman, Elizabeth K. Allison and Joseph El Khoury.Microglial Dysfunction and Defective -Amyloid Clearance Pathways in Aging Alzheimer s Disease Mice.Journal of Neuroscience 2008;28 (33) 8354-8360
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 2025年7月Science期刊精华 (2025-07-31)
- 事关产假、托育服务、住房支持等 育儿支持政策步伐一览 (2025-07-31)
- 育儿补助哪些人可以领?什么时分领?多部分回应 (2025-07-31)
- 国度医保局地下宣布第三批智能监管“两库”规定和常识点 (2025-07-31)
- 我国国民西医药安康文明素养程度达26.85% (2025-07-31)
- Nature Genetics:拨开百年迷雾!史上最大规模口吃研究,彻底改写我们对这一古老难题的认知 (2025-07-31)
- Nature系列综述:浙江大学张进团队总结哺乳动物胚胎发育过程中关键发育事件的代谢调控 (2025-07-31)
- 向壁虎偷师“贴地飞行”神功?Adv. Mater.: 仿壁虎脚的软树枝颗粒,让膀胱癌药物告别“短命”,显著抑制肿瘤生长并调动免疫 (2025-07-31)
- Environ Sci Technol:铀的同位素组成或可用于无创测量肾脏中铀的积累 (2025-07-31)
- Immunity:血液中的蛋白质可能有助于预测疟疾的严重程度 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















