精准击杀多种癌症,“合成致死”新疗法来了!已进入临床阶段 |
 |
1922年,哥伦比亚大学的生物学家Calvin Bridges博士在观察果蝇时,注意到一个有趣的现象:两个基因同时突变失活,会导致果蝇死亡;但是如果只含有其中一个基因缺陷,果蝇的生存却不受影响。这种基因协同导致细胞死亡的现象,在此后被称作合成致死(synthetic lethality)。
如今,合成致死已经成为癌症治疗的新兴热门方向。2014年,首款PARP抑制剂奥拉帕尼(Olaparib)获批上市,用于治疗BRCA1或BRCA2突变的乳腺癌, 合成致死 的概念终于走向了现实。
此后,又有多个基于合成致死机制的靶点问世,PRMT5就是其中的一支 潜力股 。
PRMT5的全称是蛋白质精氨酸甲基转移酶5。作为一种参与调控基因表达、RNA剪接、细胞周期等过程的甲基转移酶,PRMT5在多种癌症中过度表达,促进肿瘤生长。而与PRMT5协同作用的 合成致死搭档 ,则是甲硫腺苷磷酸化酶(MTAP)。
MTAP基因缺失是一类常见的癌症突变,大约10%~15%的人类癌症中都有这一突变。MTAP缺失时,细胞内的反应底物甲硫腺苷(MTA)不断积累,它们与PRMT5结合形成PRMT5/MTA复合物,抑制PRMT5的活性。因此,如果能设计一种只在PRMT5-MTA复合物存在时发挥作用的抑制剂,就可以选择性杀死MTAP缺失的癌细胞,同时避免对正常细胞的损伤。

在最新研究中,Tango Therapeutics的研究团队正是基于这一机制开展了药物分子设计。这项研究的起点,是该团队在2024年报告的一种基于MTA协同机制的PRMT5抑制剂。为了进一步提高这款PRMT5抑制剂的体内疗效,研究团队在该初始分子基础上进行优化设计,试图大幅提高活力效力、增加选择性并且延长体内半衰期。
研究团队首先观测了初始分子与PRMT5结合的晶体结构中,从中发现了3个可以重点优化的区域。如下图的A、B、C区域所示,分别是位于MTA结合位点附近的氨基吡啶、靠近哌啶环4号位的疏水小口袋,以及苯并噻唑环附近的极性残基。
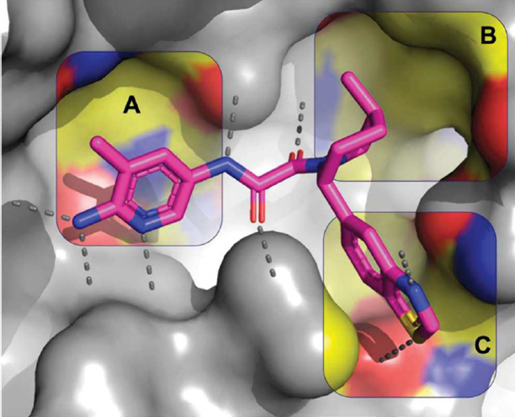
▲研究团队发现了3个可重点优化的结构区域(图片来源:参考资料[1])
接下来,作者依次对3个区域进行了大量优化设计以及化合物筛选。最终,在C区域的一项优化方案 使用N-甲基哌啶环进行取代得到的化合物51,在所有化合物中表现出了最强的效力以及良好的稳定性。而在化合物51基础上微调得到的TNG462,其效力得到进一步的提升,同时还具备高度选择性和良好的稳定性。
在体外实验中,TNG462的选择性达到了初始分子的45倍。而在犬类和食蟹猴模型实验中,研究团队评估了TNG462的药代动力学特征,其表现出中等清除率和生物利用度,并且预测的人体半衰期超过24小时,支持每日一次给药。在小细胞肺癌的异种移植模型中,TNG462表现出了强大的抗肿瘤活性,在不同给药模式下的肿瘤生长抑制率达96%,超过60%的肿瘤消退。最后,研究团队介绍了TNG462的合成路线与工艺优化。
基于上述优势,TNG462对于MTAP缺失的癌症表现出强大的治疗潜力。目前,TNG462治疗MTAP缺失的胰腺癌、肺癌等非中枢神经系统肿瘤的I/II 期临床试验正在进行。此外,根据Tango Therapeutics官网介绍,TNG462分别与RASi、帕博利珠单抗(Pembrolizumab)和SOC化疗联合使用,以及单独治疗胶质母细胞瘤的临床前试验已经完成,计划于2025年进行患者招聘。

值得一提的是,在不久前的另一篇Journal of Medicinal Chemistry论文中,该团队介绍了通过基于结构的设计工作,将S-腺苷-L-甲硫氨酸(SAM)协同的PRMT5抑制剂改造为MTA协同PRMT5抑制剂的策略。MTA与SAM竞争性结合PRMT5,但相对于PRMT5-SAM复合物,PRMT5-MTA复合物的选择性抑制可导致对MTAP缺失癌细胞的选择性杀伤。这项研究也为TNG462等新型MTA协同PRMT5抑制剂的发现奠定了基础。
参考资料:
[1] Cottrell et al., Discovery of TNG462: A Highly Potent and Selective MTA-Cooperative PRMT5 Inhibitor to Target Cancers with MTAP Deletion. Journal of Medicinal Chemistry (2025). DOI: 10.1021/acs.jmedchem.4c03067
[2] Cottrell et al., MTA-Cooperative PRMT5 Inhibitors: Mechanism Switching Through Structure-Based Design. Journal of Medicinal Chemistry (2025). DOI: 10.1021/acs.jmedchem.4c01998
医药网新闻
- 相关报道
-
- 2025年福建省药品检验技能比武圆满收官 (2025-10-23)
- 引领医药项目管理迈向新高度--第二届中国医药企业项目管理大会定于11月在京召开 (2025-10-23)
- 牙周炎伴牙龈萎缩:8款医用级修复解决方案权威推荐 (2025-10-23)
- 辽宁:2025年11月1日起全面完成生养津贴发放至团体 (2025-10-23)
- 放射科与分研院联合研究成果发表于Science子刊,为动脉粥样硬化诊疗开辟新路径 (2025-10-23)
- 用药更少、服用更不便:我国幽门螺杆菌根除医治研讨取得新突破 (2025-10-23)
- 醉酒后光止吐没用!GFX 护肝胶囊用实力护肝脏 (2025-10-23)
- Nat Biotechnol:给免疫细胞“写记忆”!科学家发明不伤DNA的基因开关,抗癌能力有望持久升级 (2025-10-23)
- 《神经病学年鉴》:评估一个简单的转身动作,或可提前8.8年预测帕金森病! (2025-10-23)
- 颠覆“一胖毁所有”!最新研究:带这种“肥胖基因”缺陷,胖却血脂低、心血管风险降,大脑才是幕后调度官 (2025-10-22)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















