培养皿里的“迷你大脑”!Mol Psychiatry:新型类器官解锁散发性阿尔茨海默病病理密码,助力药物研发 |
 |
培养皿里的“迷你大脑”!Mol Psychiatry:新型类器官解锁散发性阿尔茨海默病病理密码,助力药物研发
来源:100医药网 2025-05-30 12:18
本研究开发出含多种人类细胞的血管化神经免疫类器官,sAD患者脑提取物可诱导其出现多种AD病理,经FDA批准药物治疗后病理减轻,该模型为AD研究及药物开发提供新平台。在老龄化加剧的今天,(AD)已成为全球公共健康的重大挑战。这种以记忆衰退和认知障碍为特征的神经退行性疾病,目前正困扰着全球约5500万人,且治疗手段极为有限。值得注意的是,超过95%的AD病例为散发性阿尔茨海默病(sAD),其发病机制与遗传、环境因素的复杂相互作用密切相关,但由于缺乏合适的人类模型,相关研究长期滞后。
近日,Mol Psychiatry杂志发表了一项重要研究Alzheimer s disease patient brain extracts induce multiple pathologies in novel vascularized neuroimmune organoids for disease modeling and drug discovery,来自普渡大学的研究团队开发了一种基于人类多能(hPSC)的化神经类器官模型,首次在体外成功复现了sAD的核心病理特征,并验证了其在药物研发中的应用潜力。这一突破为AD,尤其是散发性AD的机制研究和治疗开发提供了全新的平台。

一、创新模型:构建模拟人类AD脑环境的类器官
传统AD模型多聚焦于家族性AD(fAD),依赖基因突变诱导病理,而sAD模型因缺乏明确遗传标记且需模拟复杂细胞互作,一直是领域难题。此外,动物模型与人类的种属差异常导致药物研发 临床前有效、临床失败 的困境。
本研究开发的血管化神经免疫类器官整合了人类AD脑中四种关键细胞类型:神经元、小胶质细胞、星形胶质细胞和血管内皮细胞。通过共培养人类多能干细胞衍生的神经祖细胞(NPCs)、原始巨噬细胞祖细胞(PMPs)和血管祖细胞(VPs),在三维环境中形成具有功能性血管网络和神经免疫互作的类器官。值得注意的是,该模型通过荧光标记和免疫染色验证了血管结构(CD31+内皮细胞、PDGFR +周细胞)和免疫细胞(CD45+/IBA1+小胶质细胞)的成熟,为模拟真实脑环境奠定了基础。
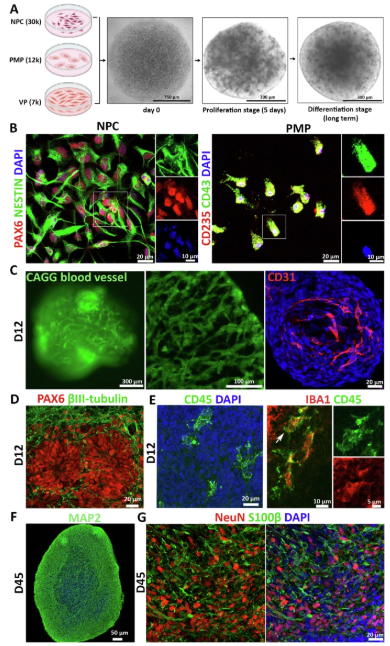
图 1 血管化神经免疫类器官的构建与表征
二、关键发现:sAD脑提取物诱导多重病理特征
研究团队利用sAD患者尸检脑组织制备的提取物(含A 和tau病理种子)处理类器官,发现短短4周内即可诱导出AD的核心病理:
1. 淀粉样蛋白(A )病理:
处理2周时,神经元内出现6E10+点状A 聚集;4周时,细胞外形成Thioflavin-S阳性的斑块样结构,且与A 42抗体共定位,证实为A 42相关沉积。
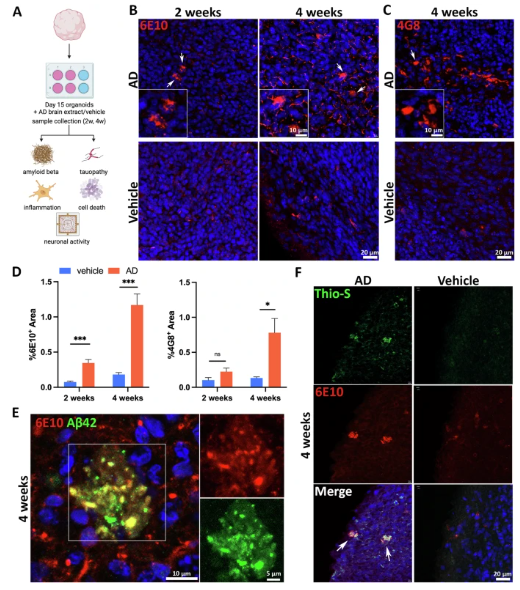
图 2 散发性AD患者来源的脑提取物诱导类器官中的淀粉样蛋白病理
2. tau蛋白病理:
磷酸化tau抗体(AT8)显示,处理2周时神经元内出现点状磷酸化tau聚集,4周时形成Gallyas银染阳性的神经原纤维缠结样结构,且与pThr217抗体共定位,提示多位点磷酸化病理。
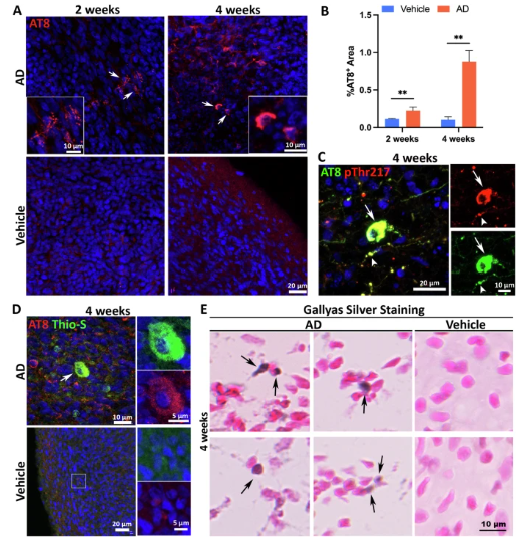
图 3 散发性AD患者来源的脑提取物诱导类器官中的tau蛋白病理
3. 神经炎症与突触损伤:
促炎因子IL-6和CCL2 mRNA水平显著升高,小胶质细胞吞噬A 的能力增强(IBA1+/6E10+共定位),但过度的突触修剪导致突触后标记物Homer1 puncta减少,神经元死亡(活化Caspase3+细胞增多)。
4. 神经功能缺陷:
微电极阵列(MEA)检测显示,处理组神经网络活动显著减弱,表现为放电频率、爆发次数减少,提示突触丢失导致的功能性损伤。
蛋白质组学分析进一步揭示,模型中差异表达的蛋白富集于AD相关通路,如突触囊泡循环、神经退行性通路等,且与人类AD脑组织蛋白特征高度重叠,验证了模型的临床相关性。
三、药物验证:靶向A 疗法的疗效与安全性评估
基于类器官成功复现AD病理,研究团队对批准的抗A 抗体药物Lecanemab进行了评估:
疗效验证:处理4周的类器官经Lecanemab治疗2周后,6E10和4G8阳性的A 负荷显著降低,且小胶质细胞对A 的吞噬作用增强(IBA1+细胞内A 信号增加),提示药物通过促进吞噬清除A 。
安全性评估:利用携带APOE ε4等位基因的类器官(模拟高风险人群),发现Lecanemab治疗后症相关基因VCAM-1表达升高,血管内皮连接蛋白VE-Cadherin表达下降,提示潜在的血管损伤风险,与临床观察到的淀粉样蛋白相关成像异常(ARIA)一致。
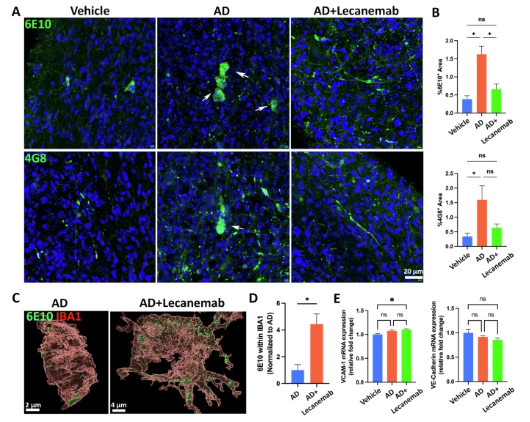
图 4 抗A 抗体Lecanemab减轻AD神经免疫类器官中的淀粉样蛋白负荷
四、未来展望:开启AD医学新征程
这项研究的突破性在于首次利用人类细胞构建了包含神经-免疫-血管互作的复杂类器官模型,不仅解决了sAD建模的难题,更通过 病理诱导-药物测试 的完整流程验证了其转化价值。与传统模型相比,该类器官具有三大优势:
1. 多细胞整合:同时包含神经元、免疫细胞和血管,可模拟AD中复杂的细胞间相互作用;
2. 快速成模:4周内诱导出成熟病理,较传统fAD类器官(需3-6个月)显著缩短研究周期;
3. 临床关联:利用患者源性病理种子诱导病理,更贴近sAD真实发病机制,且能评估药物在人类细胞环境中的响应。
随着人口老龄化加速,AD的防治需求刻不容缓。这一新型类器官模型为解析sAD发病机制、筛选靶向药物(尤其是免疫疗法)提供了前所未有的工具,有望推动AD研究从动物模型向人类精准医学跨越。正如Molecular Psychiatry同期评论指出,该模型或将成为连接基础研究与临床转化的关键桥梁,为 攻克AD 这一世纪难题开辟新路径。(100yiyao.com)
参考文献:
Ji Y, Chen X, Wang Z, et al. Alzheimer s disease patient brain extracts induce multiple pathologies in novel vascularized neuroimmune organoids for disease modeling and drug discovery.Mol Psychiatry. Published online May 2, 2025. doi:10.1038/s41380-025-03041-w
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 牙周炎伴牙龈萎缩:8款医用级修复解决方案权威推荐 (2025-10-23)
- 辽宁:2025年11月1日起全面完成生养津贴发放至团体 (2025-10-23)
- 放射科与分研院联合研究成果发表于Science子刊,为动脉粥样硬化诊疗开辟新路径 (2025-10-23)
- 用药更少、服用更不便:我国幽门螺杆菌根除医治研讨取得新突破 (2025-10-23)
- 醉酒后光止吐没用!GFX 护肝胶囊用实力护肝脏 (2025-10-23)
- Nat Biotechnol:给免疫细胞“写记忆”!科学家发明不伤DNA的基因开关,抗癌能力有望持久升级 (2025-10-23)
- 《神经病学年鉴》:评估一个简单的转身动作,或可提前8.8年预测帕金森病! (2025-10-23)
- 颠覆“一胖毁所有”!最新研究:带这种“肥胖基因”缺陷,胖却血脂低、心血管风险降,大脑才是幕后调度官 (2025-10-22)
- Nat Commun:癌细胞也有“作战指挥室”?科学家用纳米炸弹把它炸了! (2025-10-22)
- Cell:黑色素瘤细胞表面的凹陷是肿瘤杀伤热点 (2025-10-22)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















