【年度盘点】关爱罕见病——2019年美国FDA批准的孤儿药适应症 |
 |

2019年12月31日讯 /BIOON/ --孤儿药(Ophan Drug)是指用于、治疗和预防罕见病的药品,而罕见病是一类发病率极低的疾病的总称,又被称为“孤儿病”。根据世界卫生组织(WHO)的定义,患病人数占总人口0.65‰~1‰的疾病即可被定义为罕见病。不过,世界各国根据自己国家的具体情况,对罕见病的认定标准存在一定差异。
目前,国际上已经明确的罕见病超过7000种,虽然每种罕见病的患病人数较少,但整个罕见病患者群体却十分庞大,全球预计有超过3亿名罕见病患者,中国有超过1680万罕见病患者。然而,与之形成鲜明对比的是,全球已上市的孤儿药只有600多种。
孤儿药具有研发难度大、成本高、目标市场小、获利能力差等特征,因此最初很多药企并不愿涉足该领域。美国最早于1983年1月4日颁布《孤儿药法案》(ODA),之后又推出了孤儿药审评的特殊待遇,再加上临床研究和测试费用享受50%税收抵免、处方药用户收费减免以及药物获准后享有7年市场独占期等一系列支持政策,使得孤儿药的社会认知度不断提高,制药企业对孤儿药的开发热情也持续升温。近些年来,很多跨国制药巨头都纷纷加入了孤儿药研发行列,并已收获了重磅回报。
目前,孤儿药已成为医药行业最盈利的板块之一。根据今年4月底医药市场调研机构Evaluate Pharma发布的《2019年孤儿药报告》,科学的进步将助推孤儿药市场在未来6年(2019-2024)快速增长。报告指出,2018年全球孤儿药市场为1310亿美元,在未来6年(2019-2024),该市场将以12.3%的年度复合增长率快速增长,增速是同时期非孤儿药市场增速(6%)的2倍,到2024年达到2420亿美元(约合人民币16297.49亿元),其在处方药市场中的占比将首次突破20%,达到20.3%。
在孤儿药开发激励和审批方面,美国始终走在世界最前列。根据FDA孤儿药产品开发办公室(OOPD)公共数据库,自1983年《孤儿药法案》(ODA)实施以来,FDA授予的孤儿药资格数量和批准的孤儿药适应症数量逐年递增;截至目前,FDA已授予5216个孤儿药资格,批准841个孤儿药适应症。仅在2019年(截止12月31日),已授予336个孤儿药资格、批准75个孤儿药适应症。
(备注:可点击图片,查看大图)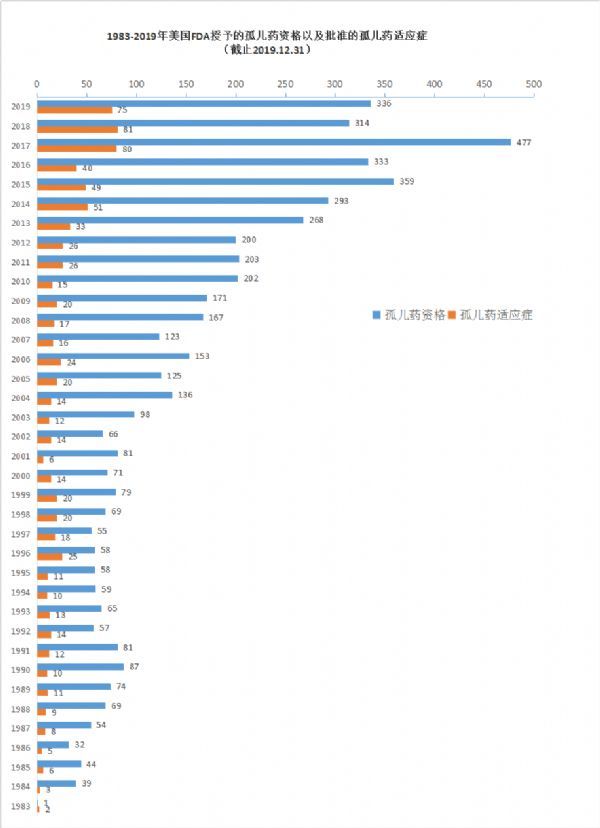
2018年5月22日,国家卫生健康委员会、科技部、工信部、国家药监局、国家中医药管理局等五部委联合制定的《第一批罕见病目录》正式发布,共收录121种疾病。其中,仅40多个病种有相关药物在全球上市,在中国上市的不到一半。随着中国药品审评审批制度的改革,未来国外已上市孤儿药将会加快进入中国市场。
以下是100医药网医药版块小编根据OOPD公共数据库对今年以来美国批准的75个孤儿药适应症的信息汇总,希望相关药物能尽快在中国上市,造福国内的罕见病患者群体。(100医药网100yiyao.com)
(备注:可点击图片,查看大图)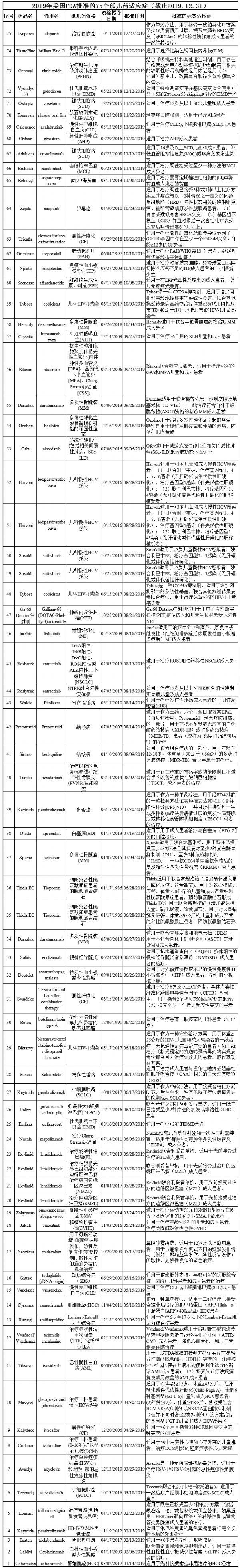
医药网新闻

- 相关报道
-
- 两篇《科学》齐发!食物过敏的背后机制找到了 (2025-08-13)
- 抑郁症治疗新方法:陈跃军/熊曼团队利用人类干细胞来源的A10亚型多巴胺能神经元改善抑郁症 (2025-08-13)
- Science:既是“脚手架”也是“束缚衣”——神经元为何必须动态重塑其周期性骨架 (2025-08-13)
- Cell Death and Disease:类器官模型揭示 ULBP2 CAR-T 细胞对胃癌的杀伤作用 (2025-08-12)
- Cell子刊:华人团队开发新型微针贴片,促进心肌梗塞后的心脏修复 (2025-08-12)
- 颜宁团队发表最新PNAS论文:助力心脏病及抗癫痫/镇痛药物精准设计 (2025-08-12)
- STTT:湖北工业大学团队发现“癌王”进展新机制和治疗新靶点! (2025-08-12)
- Nature Neuroscience:宋洪军/明国莉/周毅团队揭示人类海马新生未成熟神经元的独特演化规律 (2025-08-12)
- 第十一届马凡病友大会:以爱为翼,让健康与希望接力传递 (2025-08-11)
- Nature子刊:邹强/崔心刚/倪志宇/高强团队发现,饮食来源的半乳糖具有抗癌作用 (2025-08-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















