双重磅!西湖大学周强课题组深度解析新型冠状病毒感染人体宿主之谜 |
 |
2020年2月23日 讯 /BIOON/ --近日,关于新型冠状病毒(2019-nCoV)的研究成果可谓是层出不穷,这不,来自西湖大学周强课题组的研究人员近日在预印版平台bioRxiv连发两篇文章清楚解析了新型冠状病毒是如何侵袭人体宿主细胞的,相关研究结果或为后期研究人员改进并开发新型治疗药物提供非常有价值的线索和信息。
首先,在第一篇题为“Structure of dimeric full-length human ACE2 in complex with B0AT1”的研究报告中,研究人员利用冷冻电镜技术成功对2019新冠病毒的受体ACE2的全长结构进行了清楚地解析;血管紧张素转换酶2(ACE2,angiotensin converting enzyme2)是SARS冠状病毒(SARS-CoV)的表面受体,其能直接与刺突糖蛋白(S蛋白)相互作用,ACE2同样也被认为是2019-nCoV的受体;B0AT1(SLC6A19)是一种中性氨基酸转运蛋白,其能在需要ACE2的肠道细胞表面进行表达。
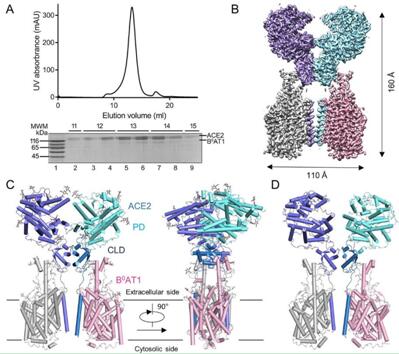
ACE2-B0AT1复合物的整体结构
图片来源:Renhong Yan,et al. bioRxiv (2020) doi:10.1101/2020.02.17.951848
来自美国德克萨斯大学等机构的研究人员通过联合研究利用冷冻电镜技术解析了新型冠状病毒S蛋白的结构,但是ACE2在细胞膜上是以什么状态存在的?2019-nCoV与SARS-CoV 在ACE2结合上又有何异同?揭示ACE2的全长蛋白及其与S蛋白的复合物结构,将有望帮助解答上述疑问。
这项研究中,研究人员展示了人类全长ACE2与B0AT1的复合体在2.9埃分辨率下的冷冻电镜结构,这种复合体能组装形成ACE2-B0AT1异二聚体结构,由于ACE2的肽酶结构域的转移,该复合体能够呈现出开放和封闭的构象。目前关于ACE2的低聚化状态并没有相关报道,研究人员所展示的ACE2-B0AT1复合体结构揭示了其二者之间的二聚体组装模式,B0AT1并不会参与同源二聚化作用,其会与ACE2的颈部区域进行广泛接触,因此,在没有B0AT1的情况下,ACE2或许会以同源二聚体的形式存在,相关研究为揭示2019-nCoV或SARS-CoV的病毒感染分子机制提供了新的线索。
有研究报道,核内体中的组织蛋白酶L能够促进SARS-CoV的S蛋白的裂解,这就揭示了一种受体所介导的细胞内吞作用机制;而ACE2作为二聚体的发现及其与三聚体S蛋白之间同时结合的相容性就表明其之间可能存在一种聚类作用,其或能促进细胞膜的内陷从而用于细胞的内吞作用,研究人员还需要进一步研究来分析ACE2和病毒颗粒之间的相互作用,以及诸如B0AT1等辅因子和整合因子对这一过程的影响效应。
对于膜融合而言,ACE2的C末端片段(尤其是697-716位点的残基)被蛋白酶(比如跨膜蛋白酶丝氨酸2,TMPRSS2)所裂解或能增强S蛋白驱动的病毒入侵过程;在研究者所展示的结构中,他们发现,697-716位点的残基能在颈部区域形成螺旋N3和N4,并映射到ACE2的二聚体界面;B0AT1的存在或许也能够阻断TMPRSS2进入到ACE2的切割位点,ACE2的表达分布要比B0AT1广泛地多,除了能在肾脏和肠道(B0AT1会主要进行表达)中表达外,ACE2还会在肺部和心脏中进行表达,然而B0AT1是否能通过阻断ACE2的裂解来抑制SARS-CoV的感染,后期研究人员还需要进一步深入研究才能得知。
第一篇研究报告中,研究者揭示了在二聚体组装过程中全长ACE2的高分辨率结构,模型研究结果表明,冠状病毒的两个S蛋白三聚体能与一个ACE2二聚体同时结合,本文研究结果为阐明2019-nCoV的感染机制及后期开发新型疗法提供了新的线索和思路。
随后在第二篇题为“Structural basis for the recognition of the 2019-nCoV by human ACE2”的研究报告中,研究人员利用冷冻电镜技术在2.9埃全分辨率条件下,在B0AT1存在的情况下,揭示了人类全长的ACE2受体与2019-nCoV 的S蛋白受体结合结构域(RBD)复合体的精细化结构;研究者表示,与诸如SARS-CoV等其它冠状病毒一样,2019-nCoV能利用S蛋白表面的受体结合结构域(RBD)与宿主细胞的ACE2进行结合。
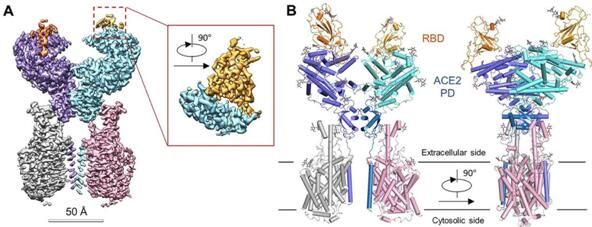
RBD-ACE2-B0AT1复合体的整体结构
图片来源:Renhong Yan,et al. bioRxiv (2020) doi:10.1101/2020.02.19.956946
第一篇研究报告中,研究者揭示了人类全长ACE2与中性氨基酸转运蛋白B0AT1复合体的结构,这篇研究中,研究人员基于此前研究结果,借助冷冻电镜技术深入解析了完整ACE2蛋白与2019-nCoV的RBD的复合物结构。研究者表示,ACE2-RBD界面的局部分辨率为3.5埃,这就能帮助他们分析RBD与受体之间的相互作用,与SARS-CoV一样,2019-nCoV的RBD会被ACE2的胞外肽酶结构域(PD,extracellular peptidase domain)通过极性残基所识别,成对比较后,研究者发现了一些特殊变异,这或许就能够解释上述两种相关病毒的RBDs之间与宿主受体之间不同的亲和性。
医药网新闻
- 相关报道
-
- 30岁男性抗初老指南,如有枣蟹可用爱廷玖盐酸达泊西汀片 (2025-08-15)
- Zn通过提高AKT甲基化改善仔猪肠道屏障功能障碍方面取得新进展 (2025-08-15)
- 中国团队突破同位素Ac-225量产技术!清华大学联合磐美迪破解全球供应困局 (2025-08-15)
- 2025年护肝片排行第一名官方旗舰店花落谁家?成分技术口碑全解析 (2025-08-15)
- 2025年度护肝片十强深度测评:成分安全与效果兼顾的优选榜单 (2025-08-15)
- 氨糖软骨素钙片质量排行榜:这份选购参考帮你理清思路 (2025-08-15)
- 将服务送到群众“家门口”——重视庆下层医疗卫生气希望构新变动 (2025-08-15)
- Nature子刊:尧唐生物吴宇轩等开发LNP-mRNA疗法,实现体内造血干细胞基因编辑 (2025-08-15)
- 八个月宝宝品牌益生菌排行榜揭晓!谁才是肠道守护真王者 (2025-08-14)
- 护肝片哪个品牌最好最安全?十大保肝护肝红黑测评,第一名护肝界的实力天花板-肝益莱! (2025-08-14)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















