重磅!背靠背两篇Nature揭示SARS |
 |
2020年4月1日讯 /BIOON /——一种新型高致病性冠状病毒(SARS-CoV-2)自2019年12月以来肆掠全球,应对这一疫情的关键是了解病毒的受体识别机制,调节其感染性、发病机制和宿主范围。而在分子和原子水平了解SARS-CoV-2如何感染细胞有利于科学家们更快开发出更有效地预防或者治疗性药物。
3月30日,Nature杂志在线发表了两项最新研究,揭示了SARS-CoV-2识别和结合人ACE2的机制及形成的复合物的晶体结构,两项研究分别为清华大学王新泉课题组和张林琦课题组合作发表的"Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor"以及明尼苏达大学李放教授课题组发表的"Structural basis of receptor recognition by SARS-CoV-2"。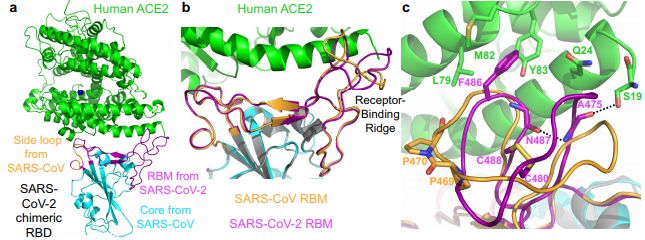
图片来源:Nature
为了在原子水平上更好地理解感染的初始步骤,我们王新泉课题组和张林琦课题组以2.45 A的分辨率确定了与细胞受体ACE2结合的SARS-CoV-2 刺突蛋白受体结合域(spike receptor binding domain,RBD)的晶体结构。SARS-CoV-2 RBD和ACE2的整体结合模式与SARS-CoV RBD几乎相同,后者也利用ACE2作为细胞受体。研究人员在SARS-CoV-2 RBD中结构分析发现了对ACE2结合至关重要的残基,其中大部分要么高度保守,要么与SARS-CoV RBD中的残基具有类似的侧链性质。研究人员发现虽然SARS-CoV-2不会在SARS和SARS相关的冠状病毒中聚集,但这种结构和序列上的相似性有力地证明了SARS-CoV-2和SARS-CoV RBDs之间的趋同进化可以改善它们与ACE2的结合。研究人员还分析了以RBD为靶点的两种SARS-CoV抗体的表位,为今后交叉反应性抗体的鉴定提供了思路。
在另一项研究中,李放教授课题组确定了与hACE2配合物中SARS-CoV-2受体结合域(RBD)的晶体结构(利用一种可以促进结晶的工程化RBD)。研究人员发现与SARS-CoV RBD相比,在SARS-CoV-2 RBD中,hACE2的结合具有更紧密的构象;此外,SARS-CoV-2 RBD中的几个残基变化稳定了RBD/hACE2界面上的两个病毒结合热点。SARS-CoV-2 RBD的这些结构特征增强了其与hACE2的结合亲和力。此外,研究人员还发现与SARS-CoV-2密切相关的蝙蝠冠状病毒RaTG13也使用hACE2作为其受体。在hACE2识别中,SARS-CoV-2、SARS-CoV和RaTG13的差异揭示了SARS-CoV-2在动物和人类之间潜在的传播途径。本研究为SARS-CoV-2靶向受体识别的干预策略提供指导。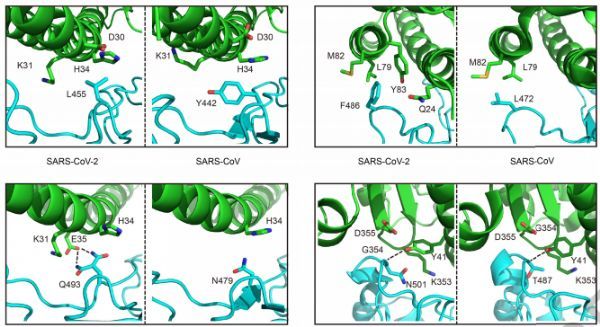
图片来源:Nature
总的来说,这两项研究利用X光晶体衍射技术,揭示了SARS-CoV-2与ACE2结合的微观晶体结构,有助于科学家了解ACE2受体介导的SARS-CoV-2识别和感染细胞的过程,可以加快科学家开发治疗性药物和疫苗的进程。(100医药网100yiyao.com)
参考资料:
【1】Lan, J., Ge, J., Yu, J. et al. Nature (2020). https://doi.org/10.1038/s41586-020-2180-5
【2】Shang, J., Ye, G., Shi, K. et al. Nature (2020). https://doi.org/10.1038/s41586-020-2179-y
医药网新闻
- 相关报道
-
- 极限赛事的 "隐形铠甲":北京和睦家多学科协同为1.5万名斯巴达勇士护航 (2025-08-14)
- 《自然·神经科学》:重启病变运动神经元!哥大学者发现,再表达ISL1和LHX3,可以减轻渐冻症表型 (2025-08-14)
- Cell子刊:我国学者研究证实,微塑料/纳米塑料已全面侵入珠峰生态系统的各个部分 (2025-08-14)
- 首届中国-东盟药膳博览会新闻发布会在京隆重召开 (2025-08-13)
- 师恩入海,核美丽助您社交无痕 (2025-08-13)
- 申报:脑机接口技术向理论利用畛域迈进的过程显著提速 (2025-08-13)
- 解读:通过初步模式审查的药品及相关信息的布告 (2025-08-13)
- 房静远团队发现盐酸小檗碱(黄连素) 具有较长期预防结直肠腺瘤切除后复发的作用 (2025-08-13)
- 十大护肝片品牌排行,护肝片哪个牌子效果最好?人群、成分、技术都有哪些? (2025-08-13)
- 你爱用AI看病吗?最新”荒诞“案例:因听从ChatGPT建议,一男子溴中毒,差点闹出人命 (2025-08-13)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















