新冠疫情:全球185万!礼来评估JAK1/2抑制剂Olumiant和Ang2单抗,治疗新冠炎症和急性肺损伤! |
 |
2020年04月13日讯 /BIOON/ --目前,国外新冠肺炎疫情仍在迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时报告》,截止2020年04月13日14时,全球累计确诊超过185万例,国外累计确诊超过177万例、死亡超过11万例。美国累计确诊超过56万例,死亡近2.2万例。欧洲累计确诊88万例,死亡超过7.6万例;其中,西班牙、意大利、法国、德国疫情最为严重,每个国家确诊均破12万例。
新冠疫情形势空前严峻,各国政府正在紧急授权,将有潜力的药物/疗法用于重症新冠肺炎的治疗,其中包括抗逆转录病毒药物、抗疟疾药物、抗炎药、康复期血浆等。当前,有多家药企已经投身新型冠状病毒肺炎(COVID-19)药物/疫苗研发行列。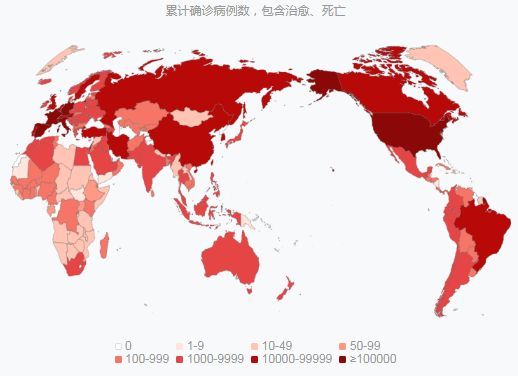
近日,(Eli Lilly)宣布已与美国国立卫生研究院(NIH)下设机构美国国家过敏和传染病研究所(NIAID)达成协议,将口服JAK1/JAK2抑制剂baricitinib纳入NIAID的适应性COVID-19治疗试验的一个组进行研究,评估baricitinib作为一种潜在治疗药物,用于治疗确诊为COVID-19的住院患者的疗效和安全性。这项研究于本月在美国启动,并计划扩展到欧洲和亚洲等其他地区。研究预计未来2个月内会有结果。
baricitinib是一种口服JAK1/JAK2抑制剂,以商品名Olumiant上市销售,在超过65个国家被批准用于治疗中重度活动性类风湿关节炎(RA)成人患者。在美国,Olumiant的处方信息中包括黑框警告,提示关于发生严重感染的风险,这种风险可能与baricitinib对免疫系统的影响有关。鉴于COVID-19中的炎性级联反应,baricitinib的抗炎活性被认为在COVID-19治疗中具有潜在的有益作用,值得在COVID-19患者中进一步研究。
加入NIAID的研究只是礼来公司致力于对抗COVID-19全球健康危机的其中一个方法。近日还宣布,将一种选择性靶向血管生成素2(Angiopoietin 2,Ang2)的研究性单克隆抗体LY3127804推进至II期临床测试,治疗有更高的风险进展为急性呼吸窘迫综合症(ARDS)的COVID-19住院肺炎患者。Ang2水平已知在ARDS患者中升高,将测试用单抗抑制Ang2的作用,在COVID-19患者中是否能减少肺炎进展至ARDS以及是否能减少对机械通气的需求。该试验将于本月晚些时候在美国几个临床治疗中心启动。
礼来首席科学官、礼来研究实验室总裁、医学博士Daniel Skovronsky表示:“正在以最快的速度前进,并利用所有可用资源帮助抗击这一流行病。为COVID-19开发潜在的治疗药物是我们至关重要的人道主义使命的一部分。要取得成功,我们必须将资源、数据和专业知识与政府、学术界和其他公司结合起来。我们期待看到baricitinib和抗Ang2单抗LY3127804临床研究的结果。”
埃默里大学医学院是NIAID正在进行的适应性COVID-19治疗试验的其中一个临床地点,该医学院医学和全球健康教授Vincent C.Marconi表示:“现在迫切需要新的策略来帮助住院的COVID-19患者,其中许多人会发展为呼吸衰竭。NIAID的这项研究提供了一个重要的机会来测试baricitinib是否能帮助这些患者。”
Olumiant的活性药物成分为baricitinib,该药是一种每日口服一次的选择性、可逆性JAK1和JAK2抑制剂,目前处于临床开发,用于多种炎症性疾病和性疾病的治疗,包括类(RA)、银屑病、肾病、特应性皮炎、系统性等。JAK酶有4种,分别为JAK1、JAK2、JAK3和TYK2。JAK-依赖性细胞因子参与多种炎症和性疾病的发病过程,提示JAK抑制剂或可广泛用于治疗各种炎症性疾病。在激酶检测试验中,baricitinib针对JAK1和JAK2表现出的抑制强度要比JAK3高出100倍。
与Incyte于2009年达成独家合作协议,共同开发Olumiant及一些后续化合物。截至目前,Olumiant已获全球60多个国家(包括美国、欧盟和日本)批准,作为一种单药或联合甲氨蝶呤,用于对一种或多种疾病修饰抗风湿药物(DMARD)缓解不足或不耐受的中度至重度活动性类(RA)成人患者的治疗。在临床研究中,与标准护理疗法(例如甲氨蝶呤单药疗法,阿达木单抗联合背景甲氨蝶呤疗法)相比,Oluminant使RA症状和体征实现显著改善。
目前,和Incyte正在合作开发Olumiant用于多种性疾病的治疗。今年1月底,双方宣布已向欧洲药品管理局(EMA)提交了baricitinib治疗中度至重度特应性皮炎(AD)的营销授权申请(MAA),并计划于2020年在美国和日本提交该适应症申请。今年3月,美国食品和药物管理局(FDA)授予评估baricitinib治疗斑秃(alopecia areata,AA)的突破性药物资格(BTD)。此次资格认定,进一步加强了baricitinib成为第一个获批准治疗斑秃患者药物的潜力。
医药网新闻
- 相关报道
-
- 2025年7月Science期刊精华 (2025-07-31)
- 事关产假、托育服务、住房支持等 育儿支持政策步伐一览 (2025-07-31)
- 育儿补助哪些人可以领?什么时分领?多部分回应 (2025-07-31)
- 国度医保局地下宣布第三批智能监管“两库”规定和常识点 (2025-07-31)
- 我国国民西医药安康文明素养程度达26.85% (2025-07-31)
- Nature Genetics:拨开百年迷雾!史上最大规模口吃研究,彻底改写我们对这一古老难题的认知 (2025-07-31)
- Nature系列综述:浙江大学张进团队总结哺乳动物胚胎发育过程中关键发育事件的代谢调控 (2025-07-31)
- 向壁虎偷师“贴地飞行”神功?Adv. Mater.: 仿壁虎脚的软树枝颗粒,让膀胱癌药物告别“短命”,显著抑制肿瘤生长并调动免疫 (2025-07-31)
- Environ Sci Technol:铀的同位素组成或可用于无创测量肾脏中铀的积累 (2025-07-31)
- Immunity:血液中的蛋白质可能有助于预测疟疾的严重程度 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















