三阴性乳腺癌逃逸免疫攻击?Commun Biol揭秘OXCT1通过修饰PGK1促进糖酵解的关键机制 |
 |
来源:100医药网 2025-07-31 09:16
本研究发现,赖氨酸甲基转移酶5A通过组蛋白甲基化促进3-氧代酸辅酶A转移酶1表达,后者经琥珀酰化修饰增强磷酸甘油酸激酶1稳定性,进而促进三阴性乳腺癌有氧糖酵解和免疫逃逸。三阴性(TNBC)作为乳腺癌中恶性程度最高的亚型,是全球乳腺癌相关死亡的重要原因。其发病率不断攀升且患者总体预后较差,对有效治疗策略的需求迫在眉睫。值得关注的是,与其他乳腺癌亚型相比,TNBC的程序性死亡受体-1(PD-1)表达更高,肿瘤浸润淋巴细胞更多,且肿瘤突变负荷较高,这意味着它更可能从治疗中获益。然而,由于其异质性和免疫抑制性微环境,TNBC对免疫检查点抑制剂(ICIs)存在耐药性,许多患者无法从中受益。
近年来,有氧糖酵解作为代谢重编程的主要途径之一,成为研究热点,被发现是逃逸的重要原因,这一过程也被称为Warburg效应,即在氧气充足的情况下仍依赖糖酵解获取能量和营养,并产生大量乳酸,利于其在不良微环境中生存。因此,通过抑制有氧糖酵解改善免疫逃逸,可能显著提高TNBC免疫治疗的疗效。
近期,发表于Commun Biol的研究OXCT1 promotes triple negative breast cancer immune escape via modulating succinylation modification of PGK1深入探讨了3-氧代酸辅酶A转移酶1(OXCT1)在TNBC中的作用及机制。

研究发现,OXCT1高表达会促进TNBC生长。通过TCGA数据库对186例TNBC组织样本分析,Kaplan-Meier生存分析显示OXCT1高表达组患者无复发生存期更短。TNBC肿瘤组织中OXCT1表达高于癌旁组织,且在Ⅰ-Ⅳ期均有升高。体外实验中,干扰OXCT1后,MD-MBA-231和BT549细胞的活性、集落形成能力显著降低;体内实验中,裸鼠肿瘤重量和体积明显减小,细胞增殖标志物Ki67的免疫组化染色显示OXCT1干扰抑制了体内MD-MBA-231细胞的增殖。
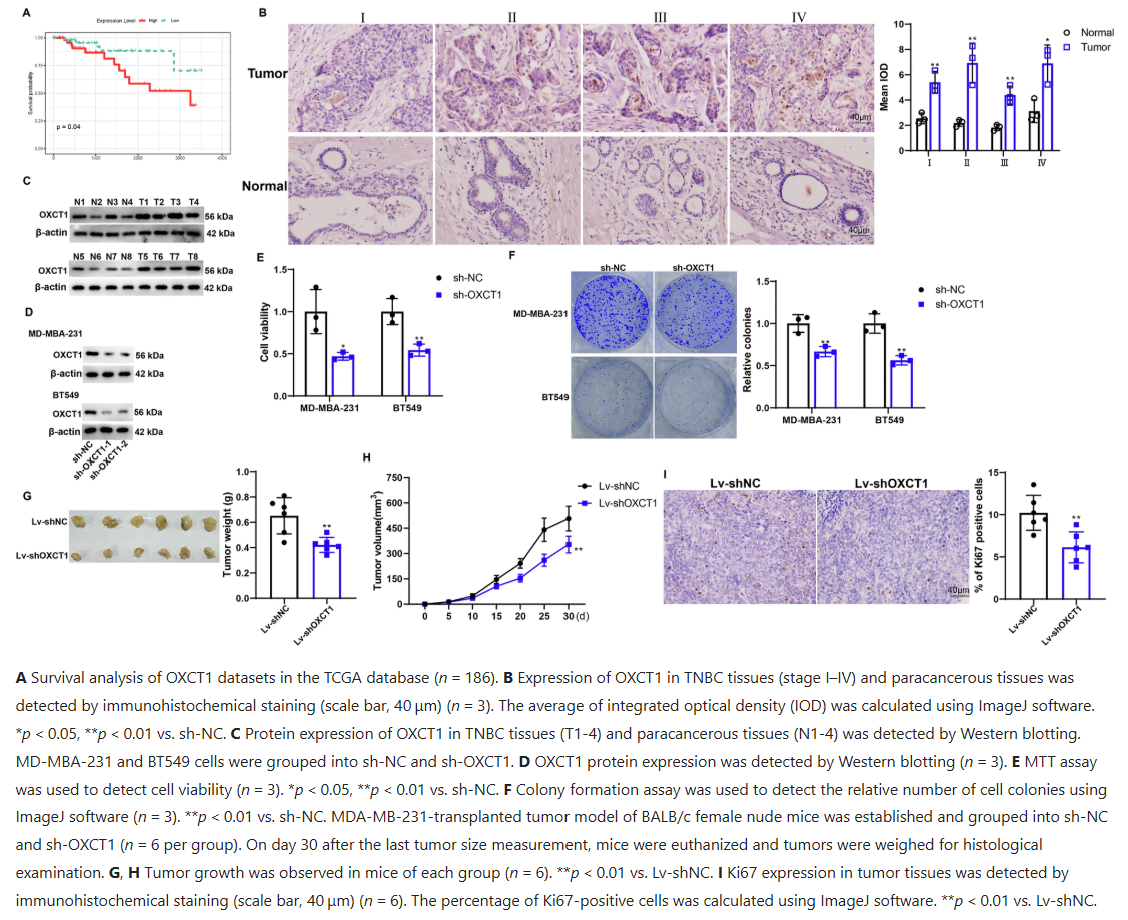
图 1:OXCT1高表达促进三阴性乳腺癌生长
OXCT1可诱导TNBC细胞的有氧糖酵解。干扰OXCT1后,TNBC细胞的基础糖酵解和糖酵解能力下降,葡萄糖消耗和乳酸分泌显著减少。过表达OXCT1会增加BT549细胞的活性和集落形成能力,而糖酵解抑制剂2-DG可逆转这一效应。此外,OXCT1与PD-L1在TNBC细胞系中的表达呈正相关,OXCT1过表达促进BT549细胞中PD-L1的表达,2-DG处理可消除该作用。在T细胞与TNBC细胞共培养实验中,OXCT1过表达使T细胞杀伤作用减弱,2-DG处理可逆转,同时OXCT1过表达对T细胞杀伤分子水平的促进作用也会被2-DG削弱。
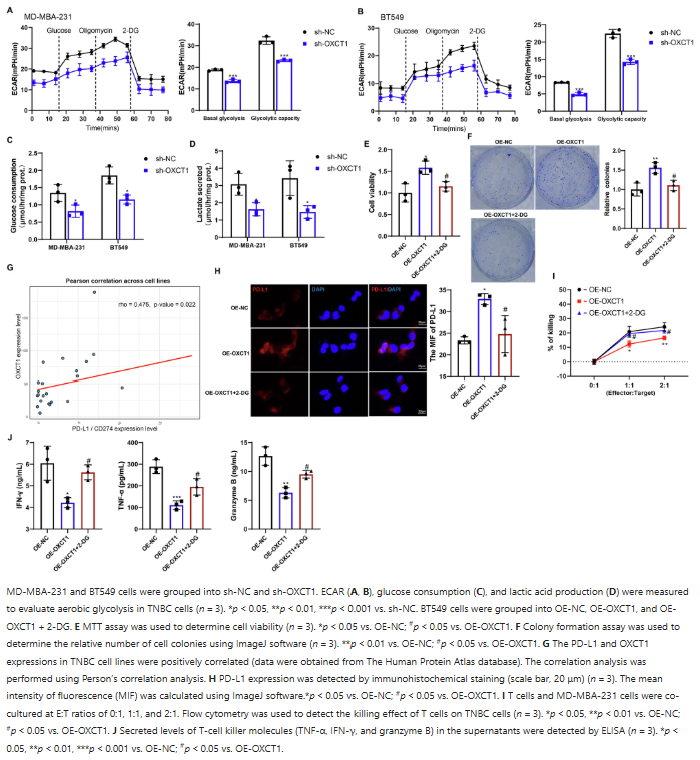
图 2:OXCT1诱导三阴性乳腺的有氧糖酵解
在TNBC患者来源类器官(PDOs)中,干扰OXCT1同样抑制有氧糖酵解和肿瘤生长。OXCT1敲低后,PDOs的Ki67阳性细胞减少,表面积和乳酸分泌降低,与T细胞共培养时肿瘤细胞凋亡增加。
从分子机制来看,OXCT1通过介导磷酸甘油酸激酶1(PGK1)的琥珀酰化修饰增加其蛋白稳定性。过表达OXCT1会提高HK2、PGK1、PFK-1和LDHA等糖酵解关键酶的蛋白表达,其中与PGK1的相关性最显著,且OXCT1对PGK1的调控发生在翻译后水平。OXCT1过表达增加PGK1的琥珀酰化水平,随CHX处理时间延长增强PGK1蛋白稳定性,同时降低其泛素化水平。蛋白降解实验显示,OXCT1干扰后PGK1的不稳定性可被蛋白酶体抑制剂MG132挽救,而非溶酶体抑制剂CQ,表明依赖蛋白酶体途径。通过预测和突变实验发现,OXCT1介导PGK1的K146位点琥珀酰化,该位点突变会消除OXCT1对PGK1蛋白稳定性的促进作用,且PGK1野生型可增加TNBC细胞活性、克隆能力和PD-L1表达,K146R突变体无此效应。
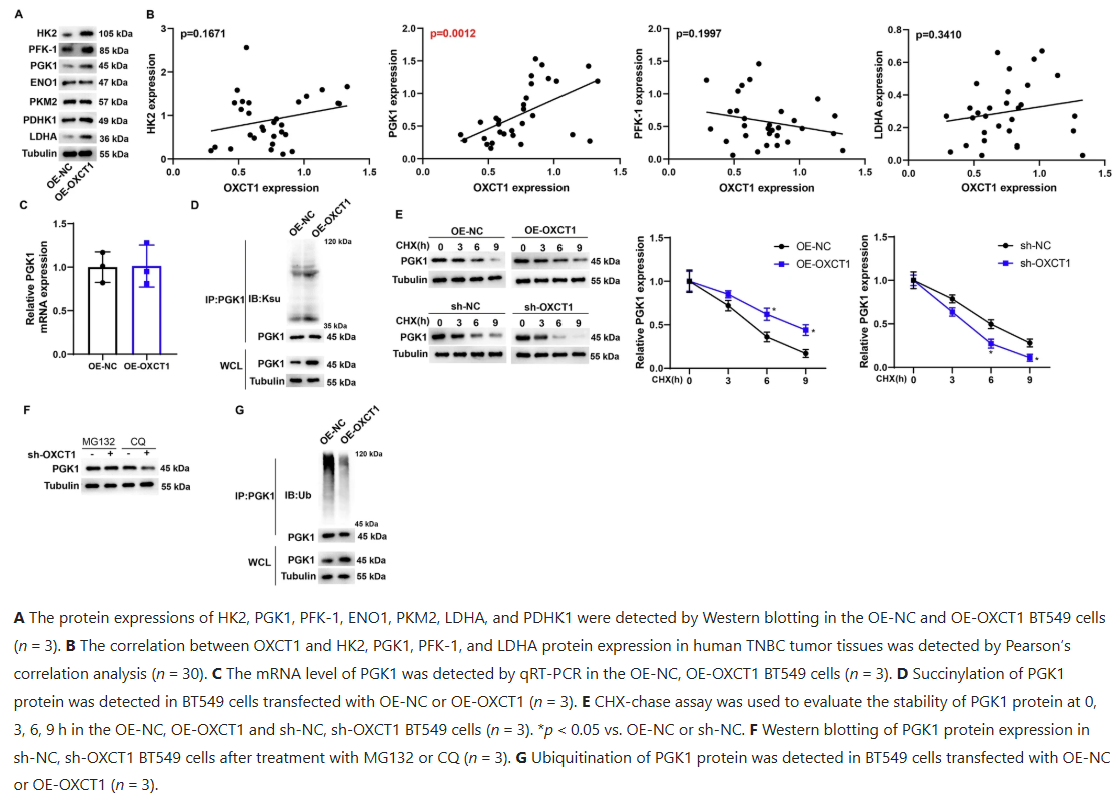
图 3:OXCT1介导磷酸甘油酸激酶1的琥珀酰化以增加其蛋白稳定性
进一步研究表明,OXCT1通过增加PGK1表达促进TNBC的有氧糖酵解。干扰PGK1可逆转OXCT1过表达对TNBC细胞活性、集落形成、PD-L1表达的促进作用,同时降低糖酵解相关指标。
此外,赖氨酸甲基转移酶5A(KMT5A)通过诱导OXCT1启动子区的H4K20me1促进OXCT1表达。TNBC组织中OXCT1启动子区H4K20me1水平升高,过表达KMT5A会增加该区域H4K20me1水平,从而上调OXCT1表达。干扰OXCT1可逆转KMT5A过表达对TNBC细胞活力、增殖和PD-L1表达的促进作用。
综上,KMT5A通过组蛋白甲基化促进OXCT1表达,OXCT1通过琥珀酰化修饰增加PGK1蛋白稳定性,进而促进TNBC的有氧糖酵解和免疫逃逸。这一研究为TNBC的治疗提供了新的靶点和思路,未来针对OXCT1或相关修饰通路的抑制剂研发,可能为改善TNBC患者的预后带来希望,让更多患者在免疫治疗中获益,减轻TNBC带来的健康威胁。(100yiyao.com)
参考文献:
Zhang H, Ling M, Zhang Y, Fang Q, Wo W, Lv X. OXCT1 promotes triple negative breast cancer immune escape via modulating succinylation modification of PGK1.Commun Biol. 2025;8(1):1033. Published 2025 Jul 9. doi:10.1038/s42003-025-08433-w
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 震惊!我国年轻、不吸烟女性肺癌发病率超男性!多项研究:40岁以下、不抽烟女性肺癌率翻倍,特别是东部沿海城市,普遍存在EGFR突变 (2025-10-07)
- Cell:空间组学终极方案?RAEFISH实现单分子与全基因组的“鱼与熊掌兼得” (2025-10-07)
- Nature Medicine:“减肥神药”的另一面:司美格鲁肽如何逆转“脂肪肝”的宿命? (2025-10-07)
- 世界首例!我国科学家创造出通用O型肾脏,并进行了首次人体移植试验 (2025-10-07)
- 研究发现组蛋白甲基转移酶组分的分子机制 (2025-10-06)
- Nature Genetics:陈万泽团队开发单细胞转录因子测序技术,剖析转录因子剂量对细胞重编程异质性的影响 (2025-10-06)
- Cell:“鱼与熊掌兼得”!王思远团队开发单分子分辨率、覆盖全基因组的空间转录组学新技术 (2025-10-05)
- Curr. Biol.:中科院物理所李岩研究组在觅食节律行为的神经机制研究方面取得重要进展 (2025-10-05)
- 水飞蓟宾护肝哪个牌子效果最好?护肝片哪个品牌最好最安全?2025口碑护肝产品公布 (2025-10-05)
- 脂肪肝、酒精肝吃哪种护肝片好?护肝片哪个牌子效果最好?三甲医生联合推荐十大品牌 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















