Nature子刊:新型CAR-T细胞,改善实体瘤治疗难题 |
 |
来源:生物世界 2025-10-07 09:05
该研究通过基因工程改造,让 CAR-T 细胞表达并原位分泌一种双功能融合蛋白——αPD-L1–IL-12,从而在肿瘤局部同时解除免疫抑制并提供激活信号,显著增强了 CAR-T 细胞在实体瘤模型中的疗效细胞疗法在实体瘤中的应用受到抑制性的肿瘤微环境(TME)的限制,这导致 T 细胞难以向肿瘤部位迁移、T 细胞耗竭、T 细胞持久性不足以及内源性抗肿瘤反应受限。
为应对这些治疗难题,研究人员已对免疫检查点抑制剂(例如 PD-1、 CTLA-4 和 PD-L1)的联合策略以及免疫调控因子(例如 IL-2、IL-7、IL-12、IL-15 和 TGF )的使用进行了研究。
免疫检查点抑制剂在治疗某些方面取得了成功,包括瘤、和非小细胞。然而,免疫学上 冷肿瘤 (例如转移性去势抵抗、和),对免疫检查点抑制剂响应有限。此外,给药问题、生物分布不佳以及全身毒性进一步使免疫检查点抑制剂及其组合的应用变得复杂。此外,将 CAR-T 细胞疗法与免疫检查点抑制剂相结合,这种显而易见的联合治疗方案,并未始终取得理想效果。
白细胞介素(IL)在先天免疫和适应性免疫反应中都发挥着关键作用,能增强 T 细胞和自然杀伤(NK)细胞活性,并在临床前模型中提高抗肿瘤响应。然而,包括 IL-12 和 IL-15 在内的许多细胞因子的临床应用受到限制,原因是其具有非肿瘤特异性活性,易引发细胞因子释放综合征(CRS)以及其他不良全身毒性。这凸显了需要采用独特的肿瘤限制性方法来联合这些疗法,以改善实体瘤免疫疗法的治疗效果。
2025 年 10 月 1 日,南加州大学凯克医学院的研究人员在 Nature 子刊Nature Biomedical Engineering上发表了题为:Solid tumour CAR-T cells engineered with fusion proteins targeting PD-L1 for localized IL-12 delivery的研究论文。
该研究通过基因工程改造,让CAR-T细胞表达并原位分泌一种双功能融合蛋白 PD-L1 IL-12,从而在肿瘤局部同时解除免疫抑制并提供激活信号,显著增强了 CAR-T 细胞在实体瘤模型中的疗效和安全性。

在这项最新研究中中,研究团队通过基因工程,让 CAR-T 细胞能够原位分泌一种双功能融合蛋白 PD-L1 IL-12,从而在肿瘤局部同时解除免疫抑制并提供激活信号,最终显著增强了 CAR-T 细胞在实体瘤模型中的疗效和安全性。
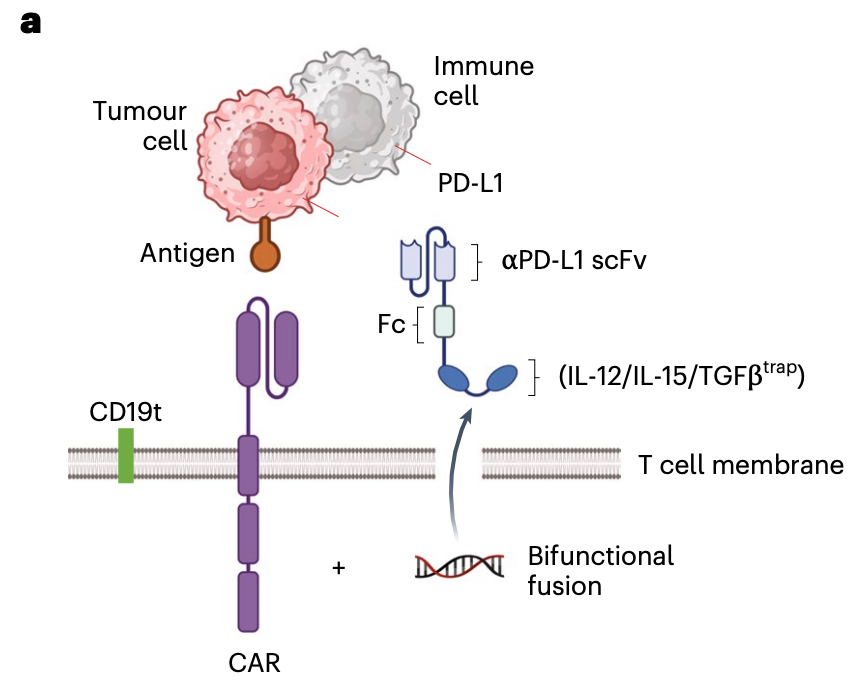
实体瘤的免疫抑制性肿瘤微环境(TME)会 关闭 或 耗竭 CAR-T 细胞,使其无法有效工作。主要抑制因素包括 免疫检查点,例如表面表达的 PD-L1 与 T 细胞表面的 PD-1 结合,传递抑制信号;抑制性细胞因子,例如 TGF- ,能强烈抑制 T 细胞的免疫活性。
研究团队设计了一种 自给自足 的 CAR-T 细胞,其表达并原位分泌一种双功能融合蛋白 PD-L1 IL-12,使其成为局部的 微型药厂 。 PD-L1 scFv 作为免疫检查点抑制剂,阻断 PD-1-PD-L1 通路,解除 T 细胞受到的 刹车 信号。IL-12 作为强效免疫刺激细胞因子,能显著增强 T 细胞的增殖、杀伤能力和持久性。这一融合蛋白将两者结合,实现了 解除抑制 + 强化激活 的协同效应。
其关键优势在于肿瘤局部作用, PD-L1-IL-12 工程化 CAR-T 细胞改善了 T 细胞的迁移和肿瘤浸润,并使 IFN 的产生、肿瘤微环境(TME)的调节以及抗肿瘤反应定位于肿瘤部位,既提高肿瘤局部的药物浓度,又同时减少了全身性炎症相关毒副作用,例如细胞因子释放综合征(CRS)。
为何 PD-L1 IL-12 的组合最优?研究团队对比了其他组合( PD-L1 TGF trap、 PD-L1 IL-15),结果显示,IL-12提供的激活信号最强,能最有效地促进 T 细胞功能;而 TGF trap虽能有效中和 TGF- ,但缺乏积极的刺激信号;IL-15 虽能促进 T 细胞存活,但其刺激强度可能不如 IL-12。 因此, PD-L1 IL-12 组合,在 解除抑制 + 强化激活 两方面做到了最佳平衡,从而在疗效和安全性上表现最优。
这项研究代表了对 CAR-T 细胞进行工程化改造以增强其对抗实体瘤能力的一个重大进步,展示了局部递送、协同作用策略的巨大潜力,有望为解决 CAR-T 细胞疗法在实体瘤中的应用难题提供一条新路径,具有广阔的临床转化前景。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nat Cancer:癌细胞“隐身术”被破!新发现让免疫系统重拾“火眼金睛” (2025-10-07)
- Nature子刊:新型CAR-T细胞,改善实体瘤治疗难题 (2025-10-07)
- 2025年诺贝尔生理学或医学奖揭晓,三位科学家因外周免疫耐受研究获奖 (2025-10-07)
- 研究揭示瘤内菌群促进肝细胞癌发生发展新机制 (2025-10-06)
- Nature Biotechnology:基因“静音”的艺术——不“剪”基因,我们如何实现精准长效的疾病调控? (2025-10-06)
- Cell子刊封面:许琛琦/施小山/王皞鹏合作揭示TCR信号多样性的脂质静电调控机制 (2025-10-06)
- 2024年诺贝尔生理学或医学奖,为何授予这两位科学家? (2025-10-06)
- 《自然·代谢》:运动后为啥不想吃饭?科学家发现,运动后的乳酸衍生物Lac-Phe能间接激活厌食性神经元,实现食欲抑制 (2025-10-05)
- 80亿美元收购Merus,Genmab的转型大棋局 (2025-10-05)
- Nature Biotechnology :里程碑式突破!研究人员成功建立具备生殖系传递潜能的通用鸟类胚胎干细胞系 (2025-10-05)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















