Science:新研究揭示可复制RNA的起源和复制机制 |
 |
2020年4月14日讯/BIOON/---虽然遗传信息通常编码在DNA中,并通过DNA模板复制的方式传递,但是RNA也可以作为物质通过RNA模板复制的方式传递。人们已经描述了两类蛋白催化的RNA复制系统。在第一种RNA复制系统中,专门的RNA依赖性RNA聚合酶复制流感病毒和登革热病毒等RNA病毒的基因组。在第二种RNA复制系统中,通常参与DNA转录成RNA的细胞酶可以复制某些RNA,比如植物类病毒(viroid)和人类丁型肝炎病毒(HDV)。利用DNA依赖性RNA聚合酶进行复制的RNA的多样性和潜在的分子机制尚未得到充分研究。
先前已经描述了可以通过噬菌体T7 DNA依赖性RNA聚合酶(T7 RNAP)在体外复制的五种RNA序列。这些可复制RNA(replicating RNA)的起源和T7 RNAP的复制要求尚不清楚。
在一项新的研究中,来自美国斯坦福大学的研究人员应用了下一代测序、微流控技术和来解决(i)DNA依赖性RNA聚合酶如何复制RNA,(ii)哪些RNA模板可被有效地复制,(iii)可复制RNA的起源。相关研究结果发表在2020年4月10日的Science期刊上,论文标题为“Transcription polymerase–catalyzed emergence of novel RNA replicons”。
 图片来自Science, 2020, doi:10.1126/science.aay0688。
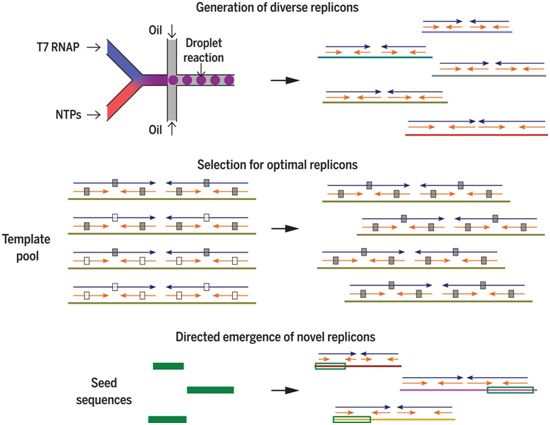
这些研究人员在没有明确添加模板的情形下建立了一系列T7 RNAP反应。这些反应产生具有不同序列的RNA复制子(RNA replicon),不过这些复制子具有由双向重复(在整个RNA长度上较长的反向重复)和四向重复(较短的反向重复嵌入在双向重复的每个臂中)确定的一致性结构框架。
图片来自Science, 2020, doi:10.1126/science.aay0688。
这些研究人员在没有明确添加模板的情形下建立了一系列T7 RNAP反应。这些反应产生具有不同序列的RNA复制子(RNA replicon),不过这些复制子具有由双向重复(在整个RNA长度上较长的反向重复)和四向重复(较短的反向重复嵌入在双向重复的每个臂中)确定的一致性结构框架。
他们发现T7 RNAP进行有效的RNA复制需要双向重复和四向重复,这提示着具有双向重复和四向重复的RNA在没有添加模板的反应中通过“适者生存”的形式在试管中出现。对双向重复的要求进一步提示着RNA形成较长的发夹结构,然而对四向重复的要求则提示着RNA在复制过程中会改变结构,这就是人们所说的RNA变形(RNA shape-shifting)。
在利用化学合成的RNA模板进行的实验中,他们还确定了无模板的3"核苷酸延伸是复制起始的关键要求。这个关键要求表明,新RNA产物的起始在模板序列内部发生,他们称之为亚末端从头起始(subterminal de novo initiation)。他们还发现具有确定的5"末端和3"末端的RNA模板可用于多轮RNA合成。这种他们称之为中断滚环合成(interrupted rolling-circle synthesis)的机制产生了由多个重复的模板序列组成的RNA产物。
在未添加模板的T7 RNAP反应中合成的RNA可能是已有序列的复制产物或从头起始过程的产物。为了区分这两种可能性,他们使用微流控技术扩大了实验通量,从而分离出数百个RNA复制子。对他们的大型复制子文库的分析使得他们提出假设,即可复制RNA可以通过从DNA种子中获得部分指令而从头开始复制。为了支持这一假设,他们证实他们自己选择的DNA种子库中新型可复制RNA的形成。他们观察到,RNA复制子由DNA种子序列信息组成,该信息已被复制和重复以产生特征性的四向重复模式,这表明聚合酶活性和分子进化步骤的特定级联导致可复制RNA的起源。
这些研究结果为自然存在的RNA遗传元件的起源和复制提供了模型,并提出了一种手段,使得各种RNA群体可以在细胞环境中充当物质。(100医药网 100yiyao.com)
参考资料:
Nimit Jain et al. . Science, 2020, doi:10.1126/science.aay0688.
医药网新闻
- 相关报道
-
- 2025年7月Science期刊精华 (2025-07-31)
- 事关产假、托育服务、住房支持等 育儿支持政策步伐一览 (2025-07-31)
- 育儿补助哪些人可以领?什么时分领?多部分回应 (2025-07-31)
- 国度医保局地下宣布第三批智能监管“两库”规定和常识点 (2025-07-31)
- 我国国民西医药安康文明素养程度达26.85% (2025-07-31)
- Nature Genetics:拨开百年迷雾!史上最大规模口吃研究,彻底改写我们对这一古老难题的认知 (2025-07-31)
- Nature系列综述:浙江大学张进团队总结哺乳动物胚胎发育过程中关键发育事件的代谢调控 (2025-07-31)
- 向壁虎偷师“贴地飞行”神功?Adv. Mater.: 仿壁虎脚的软树枝颗粒,让膀胱癌药物告别“短命”,显著抑制肿瘤生长并调动免疫 (2025-07-31)
- Environ Sci Technol:铀的同位素组成或可用于无创测量肾脏中铀的积累 (2025-07-31)
- Immunity:血液中的蛋白质可能有助于预测疟疾的严重程度 (2025-07-30)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















