了解药品专利链接系统!抢占仿制药市场 |
 |
药品是与公共健康和社会福利密切相关的重要产品,也是知识产权冲突的集中领域之一。排在中国、美国、加拿大、欧盟、韩国等之前。都建立了有效的药品专利链接制度,日本也建立了类似的新药再审查制度。
不同国家的制度框架有一些相似之处,但也有差异,化学药物和生物药物的治疗方法也不同。这是由每个国家的国情决定的,尤其是由本国创新药和仿制药产业的发展程度、医药市场的特点以及司法、行政和医疗保险制度的特点决定的。
一般来说,药品专利保护制度除了药品专利链接制度外,还包括橙书制度、专利保护期延长、实验数据保护等配套制度。本文将重点解读药品专利链接制度。
药品专利链接制度解读
2020年10月新《专利法》和2021年7月《药品专利纠纷早期解决机制实施办法(试行)》的实施,为新药交易创造了新的法律监管环境。药品专利联动是指将申请批准上市的仿制药与其原研药(创新药)的专利进行“联动”,在上市前提前解决仿制药可能存在的专利侵权问题。
药品专利链接(patent link)是一系列连接药品上市申请审批程序与专利权确认程序和纠纷解决策略的系统,涉及药品监管部门、专利管理部门和司法部门之间的复杂协作系统。
建立药品专利联动制度的目的是在仿制药审批过程中确认原创新药专利的有效性,和/或相关仿制药的技术方案是否属于原创新药专利的保护范围,以便在仿制药上市前解决可能出现的专利侵权纠纷。因此,它不仅积极防止仿制药在上市后侵犯原专利新药的商业利益,从而阻碍长期研发;d原药企的积极性,也防止仿制药上市销售使用后陷入侵权纠纷,无法继续供应患者,导致公共利益受损。
国家知识产权局发布的《药品专利纠纷早期解决机制行政裁决办法》第六条规定,化学仿制药申请人在提交药品上市许可申请时,应当对照在中国上市的原研药专利信息注册平台上公布的专利信息,对与该仿制药相关的每一项药品专利进行陈述。
图1:四种药物的专利声明

资料来源:公开资料,中国医药工业信息中心汇编。
根据规定,专利权人或者利害关系人对四类专利申报有异议的,可以自国家药品审评机构向社会公布药品上市许可申请之日起45日内,向人民法院提起诉讼或者请求国务院专利行政部门作出行政裁定。如果错过了45天的最后期限,SFDA将不会为化学仿制药的注册申请设置9个月的等待期。对第一个成功挑战4.1类并首次仿制上市的药物,给予12个月的独家激励,对部分原研药形成挑战。
图2:专利联动系统行政实施流程示意图
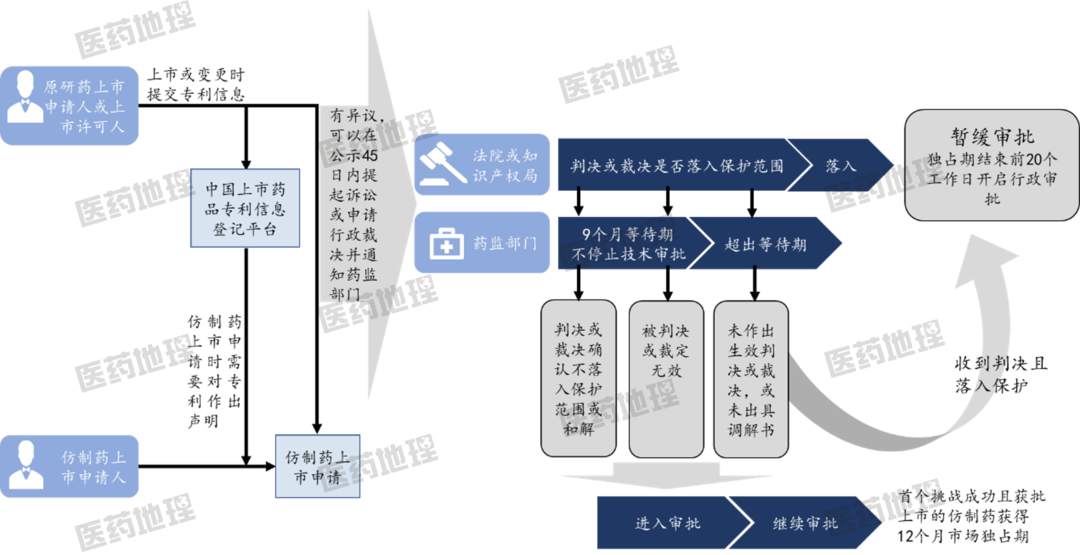
资料来源:公开资料,中国医药工业信息中心汇编。
国内药企对药品专利链接制度的实践
自2021年7月初药物专利链接系统启动以来,多种药物在4.1类中受到质疑。发起专利挑战的仿制药市场申请人包括郑达天晴、齐鲁制药、优诺康、豪森制药等多家国内药企。
其中,截至2022年2月,4.1类专利申报涉及6个药品,分别是南京海陵药业艾多沙班、海昌生物蛋白紫杉醇、乌纳康米拉贝隆、海南贺锐药业达托霉素、郑达天晴依维莫司和四川科伦药业
多沙班是一种能直接作用于凝血因子Xa的新型抗凝药物,由第一三家公司共同研发。2018年12月,甲苯磺酸依多沙班片原研获批在国内上市。2021年6月,海南希美瑞仿制药埃多沙班甲苯磺酸盐上市,为国内首家。除了海陵药业,2021年8月,南京郑达天晴发起了爱多沙班4.1类专利申报。
艾多沙班
注射用紫杉醇(白蛋白结合型)的原产品Abraxane由Abraxis BioScience公司研发,后被Celgene收购,现为百时美施贵宝的全资子公司。欧洲药品管理局(EMA)已批准该药用于乳腺癌、转移性胰腺癌和非小细胞肺癌的一线治疗。2022年1月13日, 白蛋白紫杉醇科兴生物和海昌生物在国内生产注射用紫杉醇(白蛋白结合型)获得国家美国食品药品监督管理局批准。
药品注册
Mirabellone是Anstalai开发的选择性3肾上腺素受体激动剂,用于治疗膀胱过度活动症,包括尿失禁、尿急和尿频。其缓释片于2011年7月在日本获得批准,2012年6月在美国获得批准,2012年12月在欧洲获得批准。最初的米拉贝隆缓释片于2017年10月在中国获批,商品名为倍他力。除了Unacon之外,齐鲁制药股份有限公司自2021年12月起对Mirabellon发起了4.1项专利申报。
米拉贝隆
最初研究达托霉素的是礼来公司,礼来公司将达托霉素的开发权授予了Cubist制药,随后Cubist公司被美国默克公司收购。2003年,注射用达托霉素获准在美国上市,用于治疗金黄色葡萄球菌等细菌引起的复杂皮肤和皮肤软组织感染。2006年,FDA批准注射用达托霉素用于治疗成人和儿童患者的金黄色葡萄球菌血液感染。中国批准的适应症与美国相似。
达托霉素
艾莫司片是mTOR的口服选择性抑制剂,可与细胞内蛋白FKBP12结合,从而抑制mTOR的活性。2003年在欧盟上市,2009年在美国获批,2013年进入中国,被批准用于治疗肾脏恶性 依维莫司和星形细胞瘤。现已在全球120多个国家获批上市,积累了7万多个循证案例。
肿瘤
瑞芬尼最初由拜耳公司研发,是一种口服聚激酶抑制剂,可抑制肿瘤形成、肿瘤血管生成、远处转移和肿瘤免疫逃逸。2017年12月,瑞格非尼在中国通过优先审查程序被批准用于治疗此前接受索拉非尼的肝细胞癌(HCC)患者。这是中国第一个批准用于HCC二线治疗的新药。2018年,瑞高芬尼进入2017版国家医保目录,2020年成功续保。除了四川科伦药物研究所,齐鲁制药股份有限公司于2021年9月启动了瑞格非尼片的4.1类专利申报。
瑞戈非尼
自2021年7月初,药品专利链接制度拉开序幕,国内多家药企纷纷进入,挑战原研药的专利。可以预见,未来会有更多的国内药企发起专利挑战。
对于原药企来说,提前制定应对专利挑战的策略非常重要,包括及时在上市药品专利信息注册平台上注册相关专利,专利注册后实时跟踪仿制药的专利声明。
对于仿制药企业来说,充分了解重磅药物的核心专利技术和有效期,跟踪全球研发动态,是非常重要的。d进步,通过专利突破和专利规避绕过专利纠纷,在潜在疗法领域取得仿制药市场的领先地位,对 总结的可持续发展和综合竞争力的提高具有重要意义。
医药网新闻
- 相关报道
-
- 在家门口享更好医疗服务 城市医疗资本下沉惠及下层庶民 (2025-08-04)
- 国度广电总局部署展开播送电视虚伪鼓吹医药告白集中整治 (2025-08-04)
- 《对于规范医疗机构门诊称号治理任务的关照》政策解读 (2025-08-04)
- 穗港签订单干安顿 推7项动作深入药品监管单干 (2025-08-04)
- 对于展开2025年国度医疗队巡回医疗任务的关照 (2025-08-04)
- 我国中药饮片标注保质期自8月1日起实施 (2025-07-31)
- 河北对于进一步欠缺公立医疗机构特需医疗服务治理的关照 (2025-07-30)
- 江苏对于脑机接口相关医疗服务价钱名目的公示 (2025-07-30)
- 两部分结合部署增强养老服务举措措施规划布局体例任务 (2025-07-29)
- 三部分宣布药用类麻醉 药品和精力药品目次的布告 (2025-07-29)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040






















