Nature:解析人源PBAF染色质重塑复合物结合核小体的结构 |
 |
来源:清华大学 2022-05-09 14:55
这项工作不仅阐明了PBAF复合物组装、核小体识别和染色质重塑机制,而且为理解BAF/PBAF相关突变的致病机理提供了理论基础。清华大学生命科学学院/结构生物学高精尖创新中心/清华-北大生命科学联合中心陈柱成教授研究团队在《自然》杂志在线发表题为 人源PBAF染色质重塑复合物结合核小体的结构 (Structure of human PBAF chromatin remodeling complex bound to a nucleosome)的研究论文。该论文报道了人源染色质重塑复合物PBAF在活性状态下结合核小体的结构,揭示了由12个亚基组成的PBAF复合物的组装方式和识别核小体的机制,为众多与人类疾病相关突变的致病机理提供了理论框架。
在真核生物中,DNA缠绕在组蛋白上形成核小体,经高度压缩形成染色质。这一形式一方面保证了基因组的稳定性,另一方面阻碍了诸如遗传信息的复制,转录和DNA损伤修复等生命活动。因此,染色质的动态调控对于生物具有重要作用。染色质重塑Snf2-家族马达蛋白利用ATP的能量滑动、弹出、交换或解聚核小体来,从而实现对染色质的动态调控。
BAF(BRG1-associated factors)和PBAF(polybromo-associated BRG1-associated factors)是哺乳动物SWI/SNF家族的染色质重塑复合物, 它们调控染色质结构和基因表达,广泛参与动物细胞的发育分化过程。近年来,随着高通量测序技术的发展,科研人员发现BAF/PBAF复合物的突变与超过20%的癌症,及多种神经系统发育缺陷有关。BAF/PBAF被认为是治疗癌症等重大人类疾病的潜在药物靶点。因此SWI/SNF家族复合物被广泛关注和研究。尽管早在1996年,BAF/PBAF复合物就已经被鉴定出来,但对于其组装方式和染色质重塑机制一直都不清楚。得益于冷冻电镜技术的发展,酵母SWI/SNF家族复合物及人源BAF复合物的高分辨结构先后在2019和2020年被报道。然而,对于PBAF复合物的组装方式,识别核小体的机制,其与BAF复合物的差异等问题还尚待研究。尤其是已报道的BAF复合物的核心马达亚基(SMARCA4/BRG1)处于非活性状态,不能准确解析许多与疾病相关突变的致病机理。
陈柱成教授研究团队长期深耕于染色质重塑领域,发表了一系列重要成果。在此基础上,研究团队克服技术难点,不断突破,通过体外重组的方法获得了高质量的PBAF复合物,利用冷冻电子显微镜技术,解析了PBAF结合核小体的高分辨结构(3.4埃)。
PBAF复合物的12个亚基根据功能不同,可以分成3个模块:发挥催化活性的motor模块,具有调控功能的ARP (actin-related protein)模块,和发挥染色质靶向功能的SRM模块(substrate recruitment module)。其中,PBAF的9个辅助亚基穿梭交织在一起,形成一个三叶片状的SRM模块。这些叶片根据其主要生物学功能,被命名为:核小体结合叶片(nucleosome-binding lobe,NBL),组蛋白尾巴结合叶片(histone-tail-binding lobe, HBL)和DNA结合叶片(DNA-binding lobe,DBL)。与BAF相比,HBL是PBAF特有的,包含特异亚基 PBRM1、PHF10和BRD7。这些亚基组织在一起,拥有11个结合组蛋白尾巴的结构域。研究人员认为这相当于一个超级组蛋白识别亚模块,有利于PBAF复合物在机体中更高效地感知染色质信号,发挥染色质重塑功能。这项工作还提出了PBAF结合转录因子(TF),调控基因表达的可能机理。同时,这项工作也揭示了ARID2、PBRM1等亚基位点突变致病的可能机理。
值得注意的是,本研究解析的复合物中马达亚基SMARCA4处于活性状态。在此结构中,我们可以清楚地看到疾病相关的突变主要位于高度保守的ATP结合口袋周围,和新形成的Brace-helix界面。Brace-helix活性界面介导了两个马达结构域(Lobe1与Lobe2)的相互作用,是耦合ATP水解和核小体滑动的关键元件,由陈柱成研究组于2017年首次在酵母染色质重塑蛋白Snf2中发现。在PABF的研究工作中,他们发现多个与癌症相关的SMARCA4高频突变热点就位于新形成的Brace-helix界面。而且,多个发生在旁系同源蛋白SMARCA2中与神经系统发育缺陷相关的突变也分布在这个界面。生化实验证实了这些位点的突变会显著降低染色质重塑活性,这提示病人的BAF/PBAF复合物功能的丧失。另外,高质量的电镜密度首次揭示了SMARCA4亚基的SnAc 结构域识别核小体的机制:SnAc通过3个 arginine anchor 识别核小体的酸性口袋(acidic pocket, AP),促进染色质重塑活性。
总之,这项工作不仅阐明了PBAF复合物组装、核小体识别和染色质重塑机制,而且为理解BAF/PBAF相关突变的致病机理提供了理论基础。这一发现有利于在染色质水平理解染色质重塑机制,也会推动相关疾病靶向药物的研发。
清华大学生命科学学院陈柱成教授为本文的通讯作者。清华大学生命科学学院/清华-北大生命科学联合中心2019级博士生袁俊杰和2017级博士生陈康净为本文共同第一作者,生命学院博士后张文博(已出站)也参与了重要工作。本工作获得国家、科技部重大科学研究计划专项、北京市结构生物学高精尖创新中心、清华-北大生命科学联合中心、国家蛋白质科学研究(北京)设施清华基地的大力支持。
原文链接:
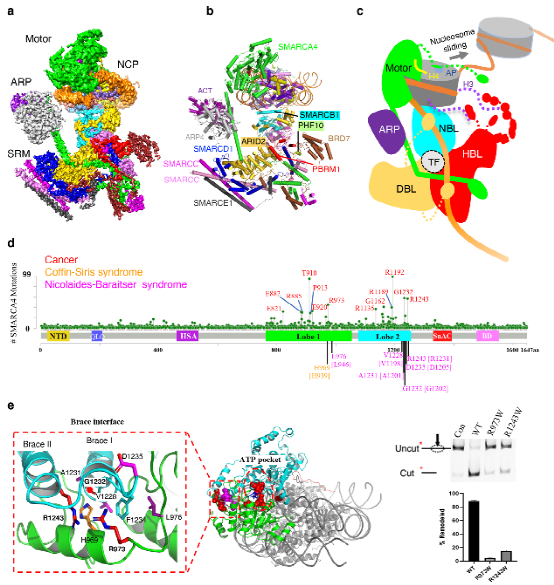
PBAF染色质重塑复合物结合核小体的结构和疾病相关突变
(a)PBAF-核小体复合物的冷冻电镜密度图。(b)PBAF-核小体复合物的结构模型。 (c)PBAF复合物识别核小体,调控染色质结构的模型。(d)3703个癌症相关的 SMARCA4错义突变位点,以及多个神经系统发育缺陷相关的SMARCA2的错义突变位点分布(数据来自COSMIC,cBioPortal和已发表文献)。以SMARCA4序列为参考,标记高频突变位点;SMARCA2突变的对应氨基酸残基在[]里。(e)疾病相关的突变位点主要位于 ATP pocket 周围和 Brace interface ,局部放大图显示了高频突变位点在Brace-helix界面的分布,右图生化实验显示R973和R1243的突变大大降低了染色质重塑活性。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Bio-Protocol:北京妇产医院刘朝晖团队成功构建“内膜外翻”的人子宫内膜类器官(含详细操作步骤) (2025-09-18)
- 18款1类新药首次在中国获批临床! (2025-09-18)
- Cell:mRNA疫苗,进军肺结核领域,增加并超越卡介苗保护效果 (2025-09-18)
- Nature子刊:AI从头设计多肽,精准抑制细胞焦亡,开辟炎症疾病治疗新途径 (2025-09-18)
- Nature:胃的“南北战争”!神经组织竟是调控胃功能分区的幕后指挥官 (2025-09-18)
- Nature Medicine:胖,但健康!遗传学如何“解绑”肥胖与心脏病的宿命关联? (2025-09-17)
- 国内唯一获批干细胞药物首位患者出院,国产干细胞药品取得临床应用突破 (2025-09-16)
- 《自然》:慢性压力毁血糖!科学家发现全新调控血糖神经通路,可快速调节肝脏糖生成,反复压力会钝化此通路,导致糖代谢受损 (2025-09-16)
- FDA监管趋严,如何影响中国创新药出海? (2025-09-16)
- JAMA子刊:重大突破!北京安定医院团队首次证实,ANK3可以预测liafensine治疗难治性抑郁症的疗效 (2025-09-16)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















