FDA监管趋严,如何影响中国创新药出海? |
 |
来源:医药魔方 2025-09-16 13:04
FDA审查趋严并非只受短期地缘政治波动影响,而是全球药品监管的长期趋势。9月10日,《纽约时报》发布报道称,特朗普政府考虑对来自中国的药品采取打击措施。该报道基于一项行政命令草案,涉及针对中美BD和数据监管的两大建议举措:
第一,对美国制药公司收购中国在研药物的交易进行更严格的审查,包括由美国外国投资委员会(CFIUS)进行评估;第二,要求对中国临床试验数据进行更严格的审查,同时对提交中国试验数据的公司收取更高的监管费用。
关于加强跨境交易审查的建议,究竟能带来多大程度上的影响尚未可知。近两年越来越多中国创新药企选择走上交易驱动路线,地缘政治有一点风吹草动,都能在业界引发恐慌。不过,也有从业者分析,政治动作的风声或许会引发短暂的交易繁荣。
关于FDA对中国临床数据的认可度问题,诺华CEO Vas Narasimhan曾对此发表观点, 停止互认临床数据的风险确实存在,但如果全球临床试验区域化分裂,药物开发进程将严重受阻 仅美国不足以完成患者招募 ,同时药企的研发成本也将增加。因此,上述建议若实施,对于美国药企来说同样意味着极大威胁。
暂且抛开未落地的 建议 不谈,对于中国药企来说,相对确定的是FDA审查将更加严格的趋势已现。
伴随全球供应链重构以及监管技术升级,FDA正通过一套 组合拳 重塑监管格局,不仅深刻影响全球制药业的竞争规则,更给积极出海的中国药企带来了前所未有的合规考验。面对国际环境日益紧张,中国药企现下能做的依然是保持严谨,在理解FDA监管变革逻辑的基础上增强竞争力。
FDA对海外临床态度:开放与警惕并存
在上述引议的报道中,《纽约时报》再次强调了特朗普政府寻求加快FDA审查流程的讨论。此前,FDA专员Marty Makary博士也提出了进一步加快药物审批速度的策略,比如国家优先审批券(CNPV)计划,但收到不少有关 偷工减料 和 审批政治化 的质疑声。
事实上,FDA确实曾因提升审批速度的牺牲了对数据量的要求。俄勒冈州立大学2023年的两项研究表示,FDA对数据较少的药物持开放态度。在2022年获批的37种药物中,有24种(65%)基于一项研究获得了批准,仅4种(约11%)在批准前报告了三项或更多研究。
不过患者招募问题仍然存在,大型药企发现仅美国患者很难满足临床试验需求,FDA不得不对海外临床数据更加开放。
CDER发布的《药物试验简报》显示,2024年,FDA批准了4种在临床试验中未纳入美国受试者的药物,涵盖治疗血液疾病、、癌症以及一种药物,与2022和2023年的2种相比,数量有所提升。
从结果上来看,FDA越来越频繁地批准无美国受试者的药物,似乎正逐步降低对美国本土受试者数据的绝对依赖,更倾向于接纳多元化的海外数据,以缩短药物审批周期、满足患者对关键治疗药物的需求。
但对于中国药企来说,FDA对数据的种族多样性要求依然十分严格,同时对美国本土生物信息安全问题也越发警惕。
FDA曾表示,不会基于仅在中国境内开展的临床试验批准药物。2022年,FDA向礼来及信达生物发出完整回复函,要求为补充美国患者群体数据。而去年获批的无美国参与者的药物,其临床试验也均在多个国家设有试验地点。
另一方面,明确表示提防中国和其他 关注国家 获取生物识别和基因组数据等敏感信息。例如,今年6月FDA宣布将停止 涉及将美国公民的活细胞送到中国和其他敌对国家进行基因工程,随后输回美国患者体内 的新研究。并表示正在审查相关试验,不会允许新试验继续进行。
但美国并没有让本土试验变得更容易。特朗普政府今年从NIH预算中削减了数十亿美元,预计将影响全美的临床资金,有从业者表示,美国药企依然在积极寻找全球其他地区临床试验的机会。
监管体系全方位升级,加强境外检查
地缘政治因素之外,FDA正迅速开展全方位监管体系升级 从 事件驱动型合规审查 转向 持续化、全球化、数据驱动型监管体系 。
近半年来,FDA推出了三项重大变革,引领美国制药行业转型:
5月6日,受总统行政命令推动,FDA宣布扩大突击式境外检查的范围,旨在解决历史上国内和海外 双重标准 的问题;
6月26日,FDA发布最终《开展远程监管评估:常见问题解答》,正式将远程监管评估(RRA)纳入其永久性监管工具库;
7月10日,作为 彻底透明化 举措的一部分,FDA在其公开平台上推出了集中式数据库,包含200多份经过编辑处理的完整回复函(CRL);
此外,FDA还正式推出生成式人工智能工具Elsa,协助工作人员完成各类审查任务,例如识别高优先级的检查目标。
上述举措表明,FDA正在强化监管体系的严密和透明程度,并进一步强调了对数据完整性的关注。这些举措不仅提高了合规门槛,更改变了行业对FDA监管的传统认知 企业需从应对单次检查转向持续的合规准备。
为实现 随时随地 监管,FDA将RRA正式纳入监管工具库,并扩大境外突击检查范围,标志着监管向实时审查迈出重要一步。2025年6月26日发布的RRA最终指南,明确了在传统现场检查之外,RRA作为 独立常设监管机制 的地位,其适用范围也不仅限于药品生产质量规范(GMP),还包括药物临床试验质量管理规范(GCP)下的临床试验执行,以及所有其他良好规范(GxP)相关活动。
从技术层面而言,企业或生产场地可以 拒绝 自愿性 RRA且不构成直接违规 ,但指南明确指出,这种拒绝可能会 延误FDA做出监管决策的进程 (包括与待审申报材料相关的决策),或 促使FDA启动传统的现场检查 。这套整合体系使FDA能够通过远程审查电子记录,以低成本、快速的方式完成分类评估;若企业拒绝RRA或提供的数据不完整,FDA便据此启动突击检查。
随时随地 监管框架的另一重要组成是FDA增加对境外生产场地突击检查的频次,其核心目的是 要求境外制造商遵守与美国本土制造商相同的标准 ,并更有效地 揭露那些可能通过提前通知检查而伪造记录、隐瞒违规行为的不良企业 。
同时也是为了回应国内药企质疑 早在新冠疫情前,FDA审查就开始受到指责, 对国内企业要求要严格得多,对海外企业却放宽了。
审查趋严早有迹象,FDA发布的《2024财年药品质量状况报告》给出数据证明。自新冠疫情以来,FDA对国内外生产商开展的药品质量保证检查(包括监督性检查和有因检查)频次显著增加。总体上,2022财年为522次,2023财年为766次,2024财年为972次,逐年增加。
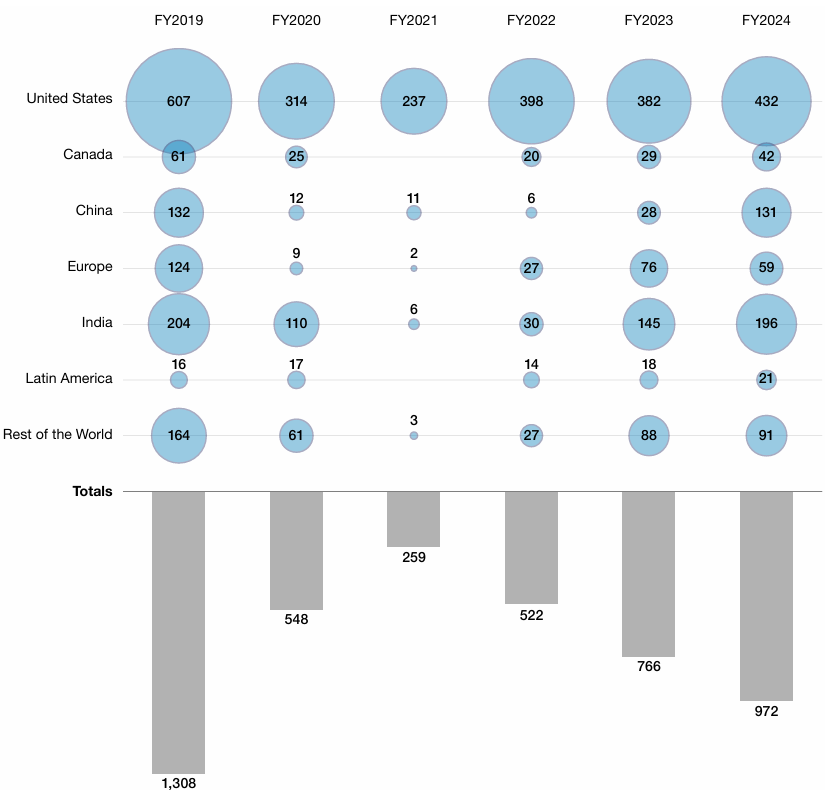
图1 2019财年至2024财年FDA按国家和地区分类的药品质量保证检查情况的项目
其中,2024财年FDA针对境外场地的药品质量保证检查达到历史最高水平,超过62%。其中印度和中国尤为显著:印度目录中34%的场地、中国目录中28%的场地均接受了检查。相比之下,2024财年美国场地目录中仅24%的场地接受了检查。
表1截至2024财年,按国家/地区划分的、最新检查结果为NAI(无整改要求)或VAI(建议自愿整改)的场地比例
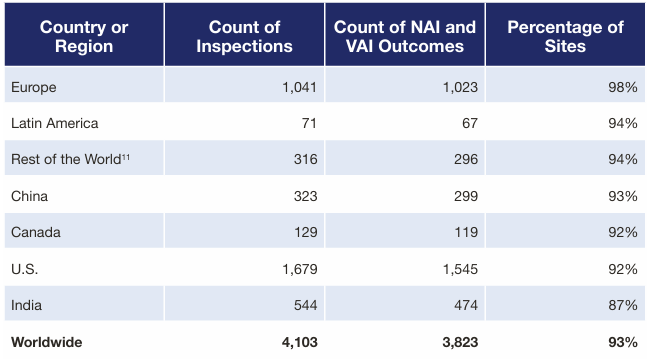
过往的行业实践已经证明,提升合规和质量要求是全球化竞争的长期通行证。CGMP检查结果可反映出各场地是否具备按FDA质量要求生产药品的能力,在FDA官网数据中,中国场地合格比例与全球平均齐平,甚至略高于美国。
综上,FDA审查趋严并非只受短期地缘政治波动影响,而是全球药品监管的长期趋势。FDA正在升级为更严格、更透明、更的监管体系,推动全球制药业提升质量标准,这也是中国药企当前能够把握的部分。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 研究揭示瘤内菌群促进肝细胞癌发生发展新机制 (2025-10-06)
- Nature Biotechnology:基因“静音”的艺术——不“剪”基因,我们如何实现精准长效的疾病调控? (2025-10-06)
- Cell子刊封面:许琛琦/施小山/王皞鹏合作揭示TCR信号多样性的脂质静电调控机制 (2025-10-06)
- 2024年诺贝尔生理学或医学奖,为何授予这两位科学家? (2025-10-06)
- 《自然·代谢》:运动后为啥不想吃饭?科学家发现,运动后的乳酸衍生物Lac-Phe能间接激活厌食性神经元,实现食欲抑制 (2025-10-05)
- 80亿美元收购Merus,Genmab的转型大棋局 (2025-10-05)
- Nature Biotechnology :里程碑式突破!研究人员成功建立具备生殖系传递潜能的通用鸟类胚胎干细胞系 (2025-10-05)
- Science:高彩霞/邱金龙合作开发植物体内快速定向进化技术——GRAPE (2025-10-04)
- Cell系列综述:北京协和医学院李宁/王书航总结ADC药物在精准癌症治疗中的挑战与创新解决方案 (2025-10-04)
- 《自然》子刊:发现新促癌T细胞!科学家发现,衰老相关癌症并非T细胞耗竭不抗癌,并找到一种功能正常但促癌的T细胞新亚型 (2025-10-04)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















