《自然·癌症》:北大、清华、华山医院团队发现“癌王”抢夺营养新机制! |
 |
来源:奇点蛋糕2022-10-11 11:30
研究人员发现,PDAC的CAF通过NUFIP1介导的核糖体自噬分泌核苷,然后通过上调PDAC细胞的MYC葡萄糖消耗促进肿瘤进展。
胰腺导管腺癌(PDAC)是最危险的癌症之一。
由于晚期和早期转移以及耐药性,PDAC的五年生存率仅为11%[1]。
PDAC的主要特征是广泛的纤维结缔组织增生,其中癌相关成纤维细胞(CAF)是促进肿瘤生长和转移的最重要的基质细胞之一[2]。CAF主要来源于静止的胰腺星状细胞(PSC)[3]。研究表明,自噬在PSC转化为CAF中起着关键作用[4]。
众所周知,自噬是一种溶酶体依赖的蛋白质降解过程,以实现细胞的代谢需要和某些细胞器的更新。研究表明,靶向干预CAFs中的自噬可以明显抑制增殖[5]。此外,自噬在肿瘤微环境中的关键作用已在许多肿瘤模型中得到证实[6]。
肿瘤微环境中的自噬被证明促进了肿瘤的发生和发展。然而,自噬在PDAC发生发展中的作用有待进一步探讨。
近日,复旦大学附属华山医院傅德良教授、清华大学药学院胡泽平教授和北京大学基础医学院赵颖教授合作,在Nature Cancer journal上发表了关于CAFs通过自噬促进PDAC发生发展的重要研究成果[7]。
研究团队证实,PDAC肿瘤微环境中的CAFs通过NUFIP1蛋白介导的自噬分泌核苷,进而上调PDAC肿瘤细胞对葡萄糖的摄取和利用,促进肿瘤进程。这一发现为PDAC的治疗提供了新的干预靶点。

报纸首页截图
接下来,我们来看看这个研究是如何进行的。
众所周知,谷氨酰胺和葡萄糖为PDAC肿瘤的生长提供了主要的碳源和氮源[8-9]。首先,研究人员发现PDAC细胞系对谷氨酰胺缺乏比葡萄糖缺乏更敏感。谷氨酰胺酶(GLS)抑制剂可以显著抑制PDAC细胞系的生长。
然而,研究人员发现,GLS抑制剂并不能抑制原位癌PDAC小鼠模型中肿瘤的生长。
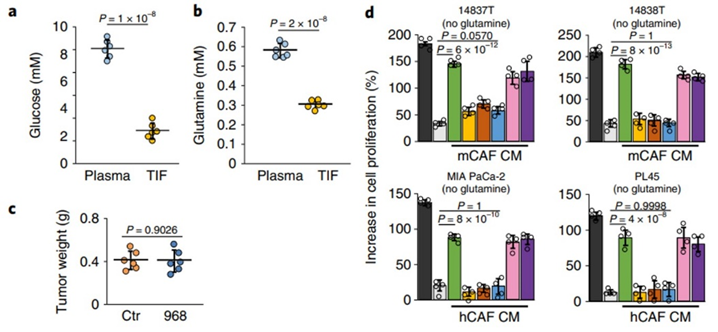
体内GLS的抑制不影响肿瘤进展。
太奇怪了。为什么体外和体内结果差别这么大?
研究人员假设,当谷氨酰胺代谢受到抑制时,PDAC的细胞外基质可能起着关键作用。癌相关成纤维细胞(CAF)是细胞外基质中最丰富的细胞。研究人员发现,在谷氨酰胺缺乏的情况下,CAF通过NUFIP1介导的核糖体自噬维持PDAC细胞的增殖。
具体来说,核糖体是由rRNA和大约80种核糖体蛋白(r蛋白)组成的复合物。在缺乏谷氨酰胺的情况下,NUFIP1结合核糖体上的rRNA,并通过降解rRNA而不是r蛋白来介导核糖体自噬。
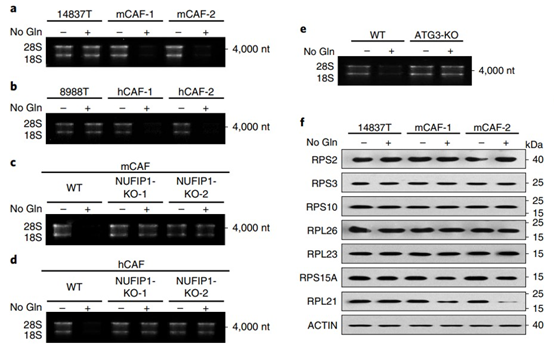
CAFs中核糖体RNA的降解被激活
那么,CAF的核糖体自噬是如何工作的呢?
众所周知,核苷是溶酶体rRNA的降解产物之一。在这里,研究人员观察到CAF分泌的核苷的细胞内和细胞外水平确实受到NUFIP1介导的溶酶体自噬的调节。
随后,研究人员验证了CAF溶酶体自噬产生的核苷是否会作用于PDAC细胞。
他们用同位素标记CAF细胞以标记其分泌的核苷,并用条件培养基(CAF-CM)培养未标记的PDAC细胞。发现CAFs产生和分泌的核苷在与PDAC共培养后逐渐耗尽。不仅如此,研究人员还证实,CAF分泌的核苷通过外源性核苷补充促进了PDAC的增殖。
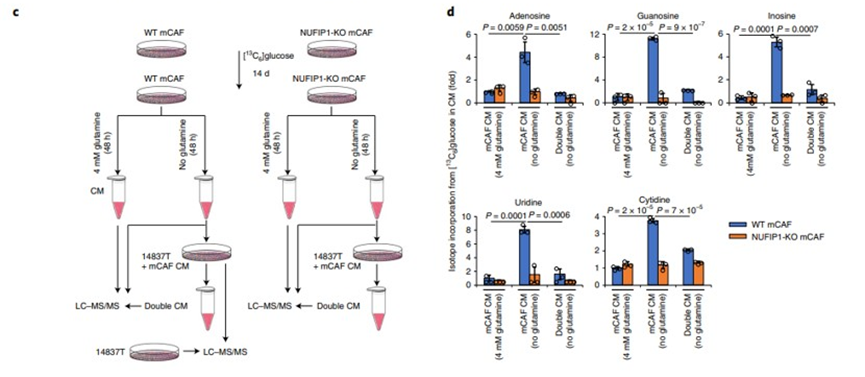
CAF分泌的核苷促进了PDAC过程。
接下来,研究人员试图找出这些核苷对PDAC细胞代谢途径的影响。
。他们发现,核苷明显上调了PDAC细胞的糖酵解及氧化磷酸化水平。然而,使用同位素示踪及对代谢流分析发现,CAF所分泌的核苷没有作为碳源参与PDAC的代谢。
有趣的是,研究人员使用基因集富集分析发现,核苷可以明显促进与葡萄糖消耗相关的基因。另外,在谷氨酰胺缺乏的情况下,研究人员通过回补核苷及CAF-CM来检测糖代谢的产物及葡萄糖转运受体的变化。结果显示,PDAC细胞中葡萄糖代谢的明显恢复,说明CAF分泌的核苷促进了PDAC细胞对葡萄糖的利用。
此外,根据基因集富集分析的结果,研究人员还揭示,在谷氨酰胺缺乏的条件下,与糖代谢相关的转录因子MYC发挥着关键作用,CAF分泌的核苷正是通过上调MYC进而激活PDAC细胞对葡萄糖的消耗。
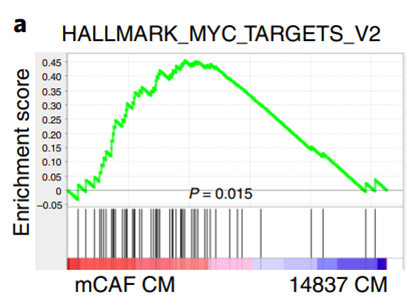
CAFs上调了PDAC中MYC的下游靶基因
为了证实上述途径在PDAC发生发展中的重要性,研究人员构建了成纤维细胞特异性NUFIP1特异性缺失的小鼠,并将PADC细胞系注射至小鼠的胰腺内。
结果表明NUFIP1敲除小鼠中肿瘤生长收到明显抑制,并伴随有肿瘤基质内核苷水平的显著降低。后续的实验证实,肿瘤基质中CAF分泌的核苷激活了PDAC细胞中的MYC,进而促进了PDAC细胞对葡萄糖的摄取和利用。
最后,研究人员还在80个患者PDAC标本中进行了组织微阵列(TMA),发现PDAC肿瘤的基质中NUFIP1蛋白的高表达与患者较差的预后相关。
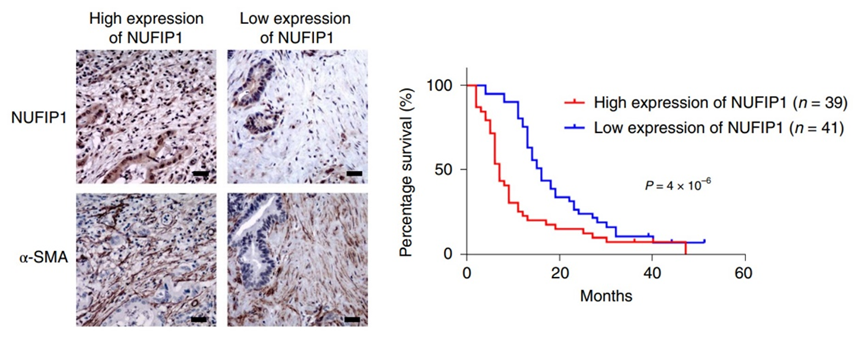
NUFIP1蛋白的高表达与患者较差的预后相关
总的来说,研究人员发现,PDAC中CAF通过NUFIP1介导的核糖体自噬分泌核苷,通过上调PDAC细胞中MYC葡萄糖消耗,进而促进肿瘤进展。阐明了PDAC中一个全新的代谢网络,为PDAC治疗提供了一个靶向NUFIP1的潜在干预手段。
参考文献
[1] Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2022.CA Cancer J Clin. 2022;72(1):7-33. doi:10.3322/caac.21708
[2] Pereira BA, Vennin C, Papanicolaou M, et al. CAF Subpopulations: A New Reservoir of Stromal Targets in Pancreatic Cancer.Trends Cancer. 2019;5(11):724-741. doi:10.1016/j.trecan.2019.09.010
[3] Neuzillet C, Tijeras-Raballand A, Ragulan C, et al. Inter- and intra-tumoural heterogeneity in cancer-associated fibroblasts of human pancreatic ductal adenocarcinoma.J Pathol. 2019;248(1):51-65. doi:10.1002/path.5224
[4] Endo S, Nakata K, Ohuchida K, et al. Autophagy Is Required for Activation of Pancreatic Stellate Cells, Associated With Pancreatic Cancer Progression and Promotes Growth of Pancreatic Tumors in Mice.Gastroenterology. 2017;152(6):1492-1506.e24. doi:10.1053/j.gastro.2017.01.010
[5] Zhang X, Sch nrogge M, Eichberg J, et al. Blocking Autophagy in Cancer-Associated Fibroblasts Supports Chemotherapy of Pancreatic Cancer Cells.Front Oncol. 2018;8:590. Published 2018 Dec 5. doi:10.3389/fonc.2018.00590
[6] Goruppi S, Jo SH, Laszlo C, Clocchiatti A, Neel V, Dotto GP. Autophagy Controls CSL/RBPJ Stability through a p62/SQSTM1-Dependent Mechanism.Cell Rep. 2018;24(12):3108-3114.e4. doi:10.1016/j.celrep.2018.08.043
[7] Yuan M, Tu B, Li H, et al. Cancer-associated fibroblasts employ NUFIP1-dependent autophagy to secrete nucleosides and support pancreatic tumor growth.Nat Cancer. 2022;3(8):945-960. doi:10.1038/s43018-022-00426-6
[8] Biancur DE, Paulo JA, Małachowska B, et al. Compensatory metabolic networks in pancreatic cancers upon perturbation of glutamine metabolism.Nat Commun. 2017;8:15965. Published 2017 Jul 3. doi:10.1038/ncomms15965
[9] Son J, Lyssiotis CA, Ying H, et al. Glutamine supports pancreatic cancer growth through a KRAS-regulated metabolic pathway [published correction appears in Nature. 2013 Jul 25;499(7459):504].Nature. 2013;496(7443):101-105. doi:10.1038/nature12040
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 华中师范大学最新Cell子刊论文:开发治疗白血病的多肽类药物 (2025-10-25)
- 《科学》:膳食脂肪重塑昼夜节律!加州大学科学家发现,饮食中不饱和脂肪酸比例会影响昼夜节律,是人体生物钟与季节匹配与否的关键 (2025-10-25)
- 河南中州实验室发表Nature Metabolism论文:揭开大脑髓鞘再生修复的关键 (2025-10-25)
- Nature Medicine:为疲惫的心脏“重启引擎”——基因疗法AB-1002能否逆转心力衰竭的宿命? (2025-10-25)
- 槲皮素哪个牌子好?槲皮素品牌前十名:肺结节该怎么选? (2025-10-25)
- 西安多欧信息咨询 :深耕医疗赛道,以全案服务赋能行业创新 (2025-10-24)
- 便秘药物最新推荐 (2025-10-24)
- 叶酸什么牌子口碑最好 (2025-10-24)
- 加科思药业在AACR-NCI-EORTC国际大会公布泛KRAS抑制剂(JAB-23E73)临床前数据 (2025-10-24)
- 纯净营养 百乐无忧 ---- 费森尤斯卡比推出全新「四"0"」乳清蛋白粉"蛋百乐™" (2025-10-24)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















