《细胞》:北京生命科学研究所曹鹏团队揭示“恶心 |
 |
来源:奇点蛋糕2022-11-16 15:13
通过各种尖端技术,曹鹏和他的团队发现,位于肠道上皮的EC细胞可以感知肠毒素。当EC细胞被激活时,它们分泌大量的血清素,表达血清素3型受体的迷走神经感觉神经纤维捕捉到这一信号后被激活。
众所周知,食用变质的食物会引起恶心、呕吐等一系列不愉快的反应。
恶心、呕吐属于身体为了防止病原体入侵身体的防御性反应。通过呕吐,身体可以促进有毒物质的排出;恶心的负面情绪使我们有可能避免再次服用类似的有毒物质[1]。
恶心呕吐作为防御性的行为和情绪,其实与神经系统的调节密不可分。那么,我们的大脑是如何感知肠道中的有毒物质,然后做出恶心呕吐的反应的呢?
之前的研究试图通过有呕吐反应的动物模型(如狗和雪貂)来解决这个问题[2]。这些研究发现,恶心和呕吐与肠脑轴密切相关[3]。前期研究还发现,肠毒素和顺铂可激活脑干孤束核,而迷走神经切断术可有效阻断肠毒素和顺铂引起的恶心呕吐[4-5]。此外,药理学方法也证明恶心呕吐与5-羟色胺3型受体和速激肽1型受体有关[6]。
但是,由于在这些动物模型中很难实现分子遗传操纵,因此肠-脑轴调节恶心呕吐的具体神经回路尚不清楚。
最近,来自北京生命科学研究所/清华大学生物医学交叉研究所的曹鹏实验室通过小鼠模型回答了这个问题。这项工作发表在著名的《细胞》杂志上[7]。
他们发现,这种毒素可以激活肠道中的肠道嗜铬细胞(EC),使这些细胞释放血清素,从而激活肠道中的迷走神经。然后,迷走神经将信号传递给延髓迷走神经背核复合体(DVC)中表达速激肽(Tac1)的神经元,该神经元被激活,通过两条神经通路调节小鼠的恶心和干呕行为。

纸质封面截图
让我们跟随奇点蛋糕,看看曹鹏和他的团队是如何开始他们的研究的。
基于小鼠模型在分子遗传操作技术上的优势,他们首先成功建立了小鼠食物中毒模型,用于研究恶心、干呕的神经调节机制。
他们发现,金黄色葡萄球菌产生的肠毒素(SEA)可以导致小鼠出现类似干呕的行为,这种行为类似于干呕。然后,通过条件性味觉回避实验(CFA),他们也证明了SEA可以使小鼠表现出类似恶心的厌恶情绪。
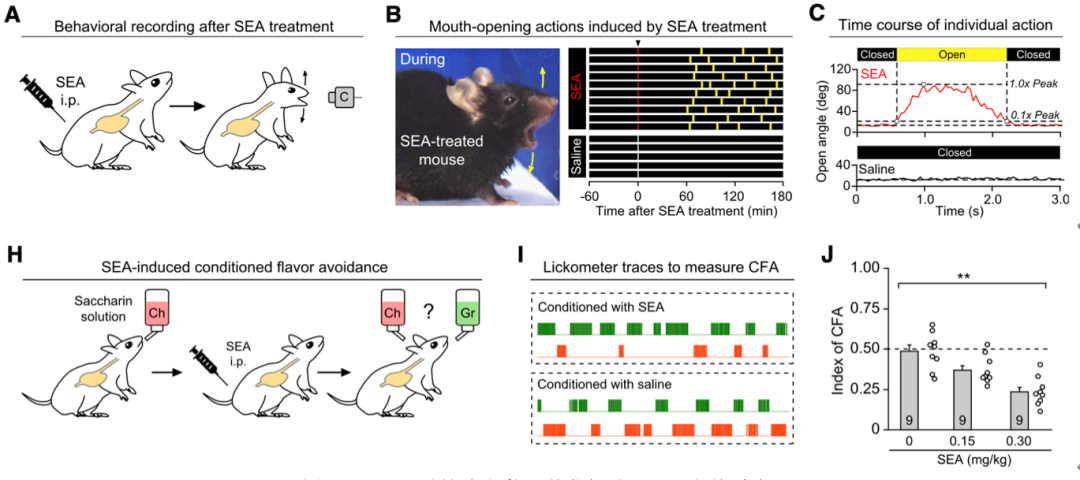
SEA可导致小鼠出现恶心和干呕。
因为之前的研究表明迷走神经与恶心呕吐密切相关,所以他们首先对小鼠进行了迷走神经切断术。结果表明,切断迷走神经后,这些小鼠对sea的恶心和干呕反应明显减轻。由于迷走神经投射的主要脑区之一是延髓的DVC,包括孤束核(NTS)和后极区(AP),他们随后探索了DVC是否在调节sea引起的恶心和干呕中起重要作用。
他们发现,DVC地区的神经元在sea给药后被高度激活,对这些神经元的特异性抑制可以显著减轻SEA引起的恶心和干呕反应。
那么,DVC的哪一个神经元负责调节恶心和干呕?
以前的研究表明,DVC地区有丰富的表达Tac1的神经元,一些研究表明,抑制Tac1受体,即神经激肽1型受体,可以有效地阻断呕吐,因此作者怀疑DVC地区的Tac1神经元负责调节肠毒素引起的恶心和干呕。
为了证明这一猜想,他们通过化学遗传学方法特异性抑制DVC区的Tac1神经元,发现这可以显著抑制sea诱导的恶心和干呕。
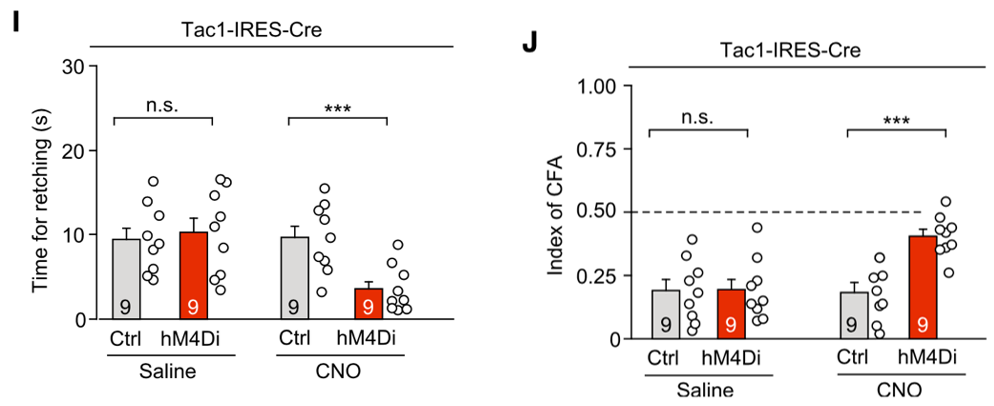
特异性抑制DVC区Tac1神经元可显著减轻sea引起的恶心呕吐。
此外,发现由这些Tac1神经元分泌的Tac1相关神经递质和谷氨酸盐是这些神经元诱导恶心和干呕所必需的。
下一个问题是,DVC的Tac1神经元如何获得肠毒素的信号?
用逆行示踪病毒标记DVC的Tac1神经元,检测胃窦和小肠绒毛的粘膜末梢(粘膜
l endings)处发现了被标记的迷走神经纤维。在小肠里的黏膜末梢处,有一群细胞叫做肠嗜铬细胞(EC)。作者们惊奇地发现这些被标记的迷走神经纤维非常靠近于EC细胞。因此,他们猜想这些EC细胞可以激活迷走神经元。
他们首先用染色的方法证明,大部分被标记的迷走神经元表达五羟色胺的受体 五羟色胺3型受体。接着他们发现,特异性敲除EC细胞中的五羟色胺可以明显抑制SEA引发的恶心干呕反应。也就是说EC细胞确实在SEA模型中激活了迷走神经元,而且这个通路是引发恶心干呕反应所必须的。
然后,作者们利用活体光纤钙成像技术测量DVC处Tac1+神经元在SEA模型中的反应活性,并且分别与膈下迷走神经切断术和HT3R拮抗剂处理组进行比较。结果显示,SEA模型中Tac1+神经元被激活依赖于迷走神经 DVCTac1+神经元的信号传输。
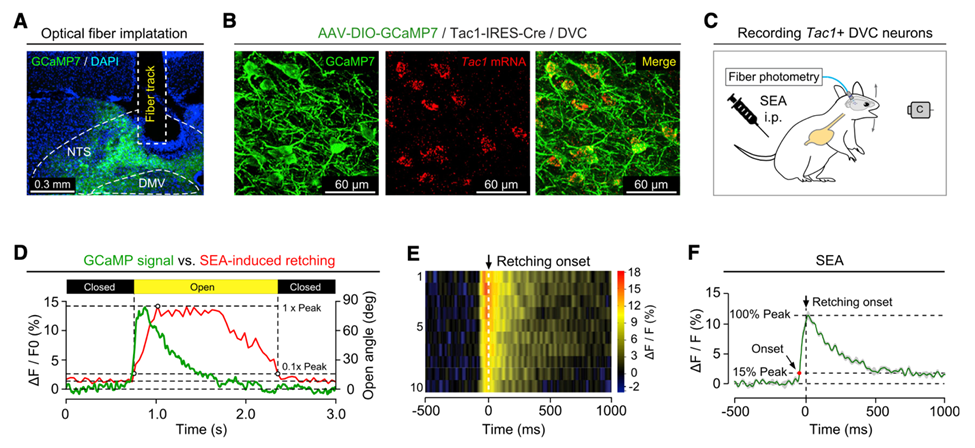
活体光纤钙成像技术证明SEA模型中DVC处Tac1+神经元被激活
那么,DVC的Tac1+神经元在SEA模型中被激活后,是如何引发恶心和干呕反应的呢?
为解答这个问题,作者们对DVC的Tac1+神经元进行了顺行示踪病毒追踪,他们发现这些Tac1+神经元主要投射到脑桥臂旁外侧核(LPB)、腹侧呼吸组吻端( rVRG)两个脑区。
他们还发现这两个神经回路几乎不存在重叠,也就是说在DVC有两个亚群的Tac1+神经元,它们分别投射到LPB和rVRG。有意思的是,作者们通过化学遗传学技术,发现这两个回路分别控制恶心和干呕两个反应:
①特异性激活DVCTac1+ rVRG神经回路只引起小鼠的干呕样行为,但不诱发条件性味觉回避行为;
②特异性激活DVCTac1+ LPB神经回路则不引起干呕样行为,却可以诱发条件性味觉回避行为。
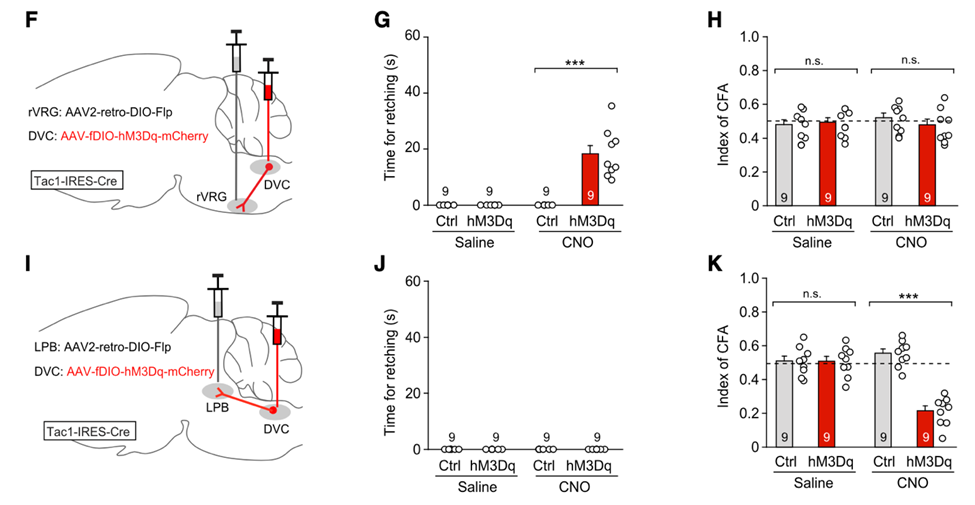
特异性激活DVCTac1+ rVRG或DVCTac1+ LPB神经回路对于SEA诱发的恶心和干呕反应的影响
除了食物毒素以外,化疗药物,比如顺铂和阿霉素,也会引发患者恶心干呕的行为。因此,作者们接下来探究上述神经回路是否也参与到了化疗药物引发的恶心干呕反应中。
他们发现,腹腔注射阿霉素能够诱发小鼠出现恶心呕吐的行为,而特异性抑制DVCTac1+神经元、特异性敲除DVC区Tac1基因或者谷氨酸合成相关的基因,均能明显减弱这一现象。
另外,如果特异性抑制DVCTac1+ rVRG回路,则可以特异性减弱阿霉素引起的干呕反应,而抑制DVCTac1+ LPB回路则特异性减弱恶心行为。
综上所述,通过多种前沿的技术,曹鹏和他的团队发现位于肠道上皮的EC细胞可以感知肠毒素。EC细胞被激活后会分泌大量五羟色胺,表达五羟色胺3型受体的迷走感觉神经纤维捕获这一信号后被激活,进而将信号传入到位于延髓的DVC的Tac1+神经元。接着,Tac1+神经元将信号传输至LPB和rVRG两个脑区,分别引起恶心和干呕的反应。而上述的神经回路通路也参与到了化疗药物引发的恶心干呕反应中。
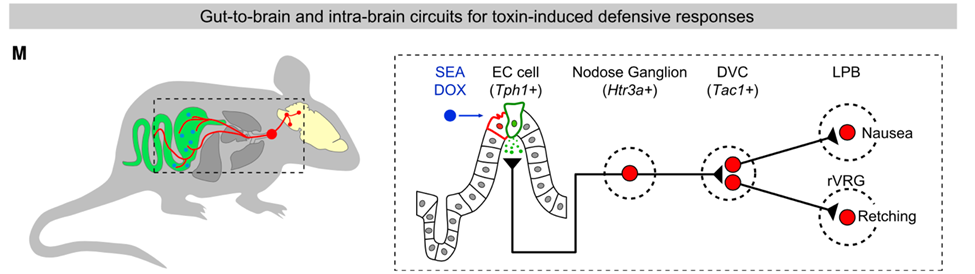
总结模型
此研究成果不仅加深了学界对肠-脑轴的认识,也为将来临床上对于恶心呕吐的治疗和干预提供了潜在靶点。
参考文献:
[1]. Horn CC. Why is the neurobiology of nausea and vomiting so important?. Appetite. 2008;50(2-3):430-434. doi:10.1016/j.appet.2007.09.015
[2]. Andrews PL, Horn CC. Signals for nausea and emesis: Implications for models of upper gastrointestinal diseases. Auton Neurosci. 2006;125(1-2):100-115. doi:10.1016/j.autneu.2006.01.008
[3]. Zhong W, Shahbaz O, Teskey G, et al. Mechanisms of Nausea and Vomiting: Current Knowledge and Recent Advances in Intracellular Emetic Signaling Systems. Int J Mol Sci. 2021;22(11):5797. Published 2021 May 28. doi:10.3390/ijms22115797
[4]. Reynolds DJ, Barber NA, Grahame-Smith DG, Leslie RA. Cisplatin-evoked induction of c-fos protein in the brainstem of the ferret: the effect of cervical vagotomy and the anti-emetic 5-HT3 receptor antagonist granisetron (BRL 43694). Brain Res. 1991;565(2):231-236. doi:10.1016/0006-8993(91)91654-j
[5]. Wang X, Wang BR, Zhang XJ, Duan XL, Guo X, Ju G. Fos expression in the rat brain after intraperitoneal injection of Staphylococcus enterotoxin B and the effect of vagotomy. Neurochem Res. 2004;29(9):1667-1674. doi:10.1023/b:nere.0000035801.81825.2a
[6]. Rojas C, Raje M, Tsukamoto T, Slusher BS. Molecular mechanisms of 5-HT(3) and NK(1) receptor antagonists in prevention of emesis. Eur J Pharmacol. 2014;722:26-37. doi:10.1016/j.ejphar.2013.08.049
[7]. Xie Z, Zhang X, Zhao M, et al. The gut-to-brain axis for toxin-induced defensive responses. Cell. 2022;185(23):4298-4316.e21. doi:10.1016/j.cell.2022.10.001
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















