Nature Communications:阐述了细菌通过DNA硫化修饰激活SspE抵抗噬菌体感染的结构和功能机制 |
 |
来源:上海交通大学2022-11-22 10336019
近日,上海交通大学生命科学与技术学院/微生物代谢国家重点实验室吴耕教授团队与武汉大学王连荣教授、陈石教授团队合作,阐明链霉菌等细菌通过对DNA进行磷酰化修饰,激活细菌中SspE蛋白的核酸酶活性,对入侵细菌有害。
近日,上海交通大学生命科学与技术学院/微生物代谢国家重点实验室吴耕教授团队与武汉大学王连荣教授和陈石教授团队合作,阐明了链霉菌等细菌通过对DNA进行磷酰化修饰激活细菌中SspE蛋白核酸酶活性,并切割入侵细菌的噬菌体DNA以抵抗噬菌体感染的结构和功能机制。该研究阐明了细菌如何通过DNA磷酰化修饰激活SspE蛋白实现对噬菌体感染的抵抗,加深了人们对DNA磷酰化修饰功能的认识。该研究成果发表在《Nature Communications》,标题为sspe提出的DNA硫代磷酸酯传感反相防御屏障下的偶联识别-激活切口机制。吴、王连荣和教授是合著者。本文是2018年吴耕团队在Nature Communications上发表的《细菌识别DNA硫化修饰的结构机理》、2020年在Nature Microbiology上发表的《型DNA硫化修饰的SspB和SspE结构》、2020年在mBio上发表的《型DNA硫化修饰的SspA结构》、2022年在mBio上发表的《型DNA硫化修饰的DndE结构》的延续和扩展。
DNA的磷硫代化包括两种类型:dndABCDE基因簇编码的蛋白介导的双链I型修饰和sspABCD基因簇编码的蛋白介导的单链II型修饰。sspE是sspABCD基因簇附近的SspE基因编码的核酸酶,长度为700-800个氨基酸。它由具有GTP酶活性的N-末端结构域(NTD)和具有notch核酸酶活性的C-末端结构域(CTD)组成。
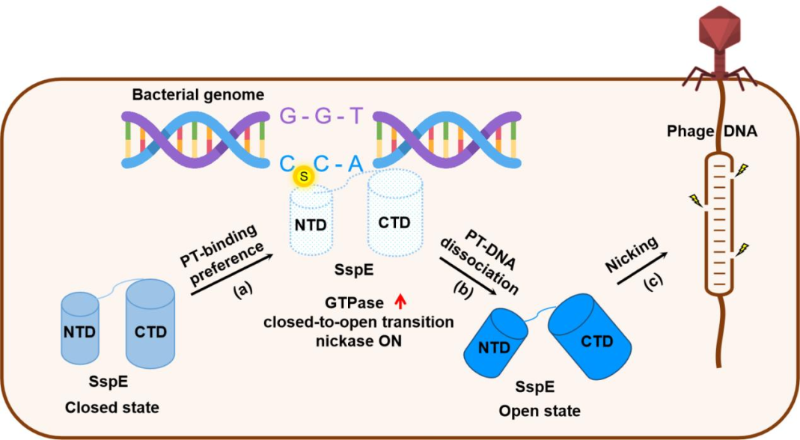
图:细菌硫化修饰基因组DNA激活SspE的核酸酶活性,切割噬菌体DNA抵抗噬菌体感染的机理。
首先,通过分析链霉菌SspE的CTD结构域的2.7埃分辨率晶体结构和全长SspE蛋白的3.4埃分辨率晶体结构,本研究发现SspE的NTD和CTD结构域形成独立的折叠三级结构,NTD和CTD通过一个短环连接,而NTD和CTD之间没有紧密的联系。SspE的NTD含有DGQQR基序,能识别并水解GTP。Ssp的CTD含有HNH基序,它能将共价闭合的环状DNA切割成开放的环状DNA。SspE-CTD上HNH基序的突变会使其失去对噬菌体感染的抗性。
然后,通过分子对接计算和定点突变株的GTP酶活性实验,发现SspE通过NTD结构域表面的一个疏水结合口袋识别细菌硫代磷酸修饰的DNA,硫化DNA的这个结合口袋中氨基酸残基的突变会破坏SspE的GTP酶活性及其抗噬菌体感染的能力。
然后,通过非变性凝胶电泳迁移实验,发现SspE的CTD结构域可以与噬菌体DNA结合,而SspE-CTD的一个保守且带正电荷的凹面上的一个重要残基的突变,会破坏SspE与噬菌体DNA的结合,使SspE失去对噬菌体感染的防御功能。此外,SspE的CTD与DNA的结合依赖于NTD对GTP的水解。
最后,有趣的是,本研究发现R100E突变可以使SspE失去GTP酶活性和DNA切割酶活性,但R100位点不在GTP酶活性位点或DNA切割酶活性位点。因此,本研究分析了SspE-R100E突变体的3.48埃分辨率晶体结构,发现与野生型SspE相比,SspE-R100E突变体的CTD结构域向NTD结构域移动了2.6-3.9埃,这表明SspE存在两个结构域相对移动引起的构象变化。荧光共振能量转移实验证实,细菌硫代磷酸修饰DNA的结合和GTP的水解确实能引起溶液中SspE蛋白的构象变化。
纸质链接:
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-


- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















