CIR:靶向肿瘤相关巨噬细胞的汽车 |
 |
来源:奇点蛋糕2022-11-23 20336019
本研究结果从概念上证明了靶向巨噬细胞表面F4/80的CAR-T细胞可以发挥良好的抗肿瘤作用。其机制包括清除TAM具有免疫抑制作用;上调肿瘤细胞表面MHC,促进内源性T细胞免疫应答。
目前,疗法正在肿瘤治疗领域掀起一场革命,但仍有许多患者对免疫疗法反应不佳。肿瘤相关巨噬细胞(TAM)是治疗耐药性的重要原因[1]。
TAM是肿瘤微环境(TME)中最丰富的免疫细胞,肿瘤中的TAM通常起到促进肿瘤发生发展的作用[2]。因此,清除TAM可能是改变TME免疫抑制环境和促进抗反应的一种方法。然而,早期开发的CSF1/CSF1R轴抑制剂在临床上并不有效[3],这表明我们仍然需要找到更好的治疗策略。
最近,西奈山伊坎医学院的Brian D. Brown和Miriam Merad领导的研究小组在《癌症免疫学研究》杂志上发表了这项研究成果[4]。他们发现,靶向F4/80不仅可以有效消除TAM,解除TAM引起的免疫抑制,还可以增强肿瘤抗原特异性T细胞的免疫反应,从而抑制各种肿瘤的生长。

报纸首页截图
研究小组首先设计了CAR-T细胞(F4。CAR-T)靶向巨噬细胞表面的特异性标志物F4/80,然后与小鼠巨噬细胞或中性粒细胞孵育,检测CAR-T对巨噬细胞的特异性杀伤能力。
结果显示F4。CAR-T可以特异性地杀死巨噬细胞而不损伤中性粒细胞。接下来,他们测试了F4的杀伤能力和安全性。小鼠巨噬细胞的CAR-T。这些老鼠输了F4。CAR-T显示没有应激或死亡病例,在输注CAR-T细胞12天后,小鼠脾脏中的巨噬细胞数量减少了80%。
这些数据表明F4。CAR-T可以有效且特异性地杀死巨噬细胞。
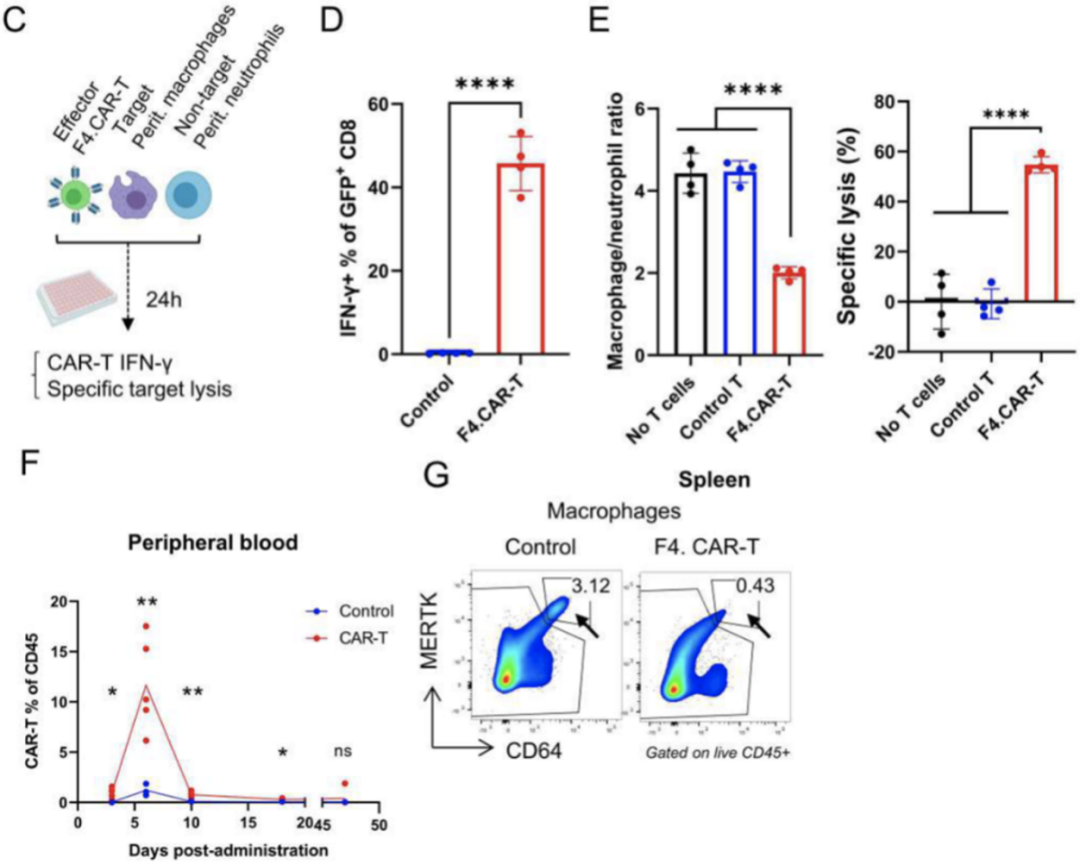
F4。CAR-T能有效杀死巨噬细胞。
F4也可以。CAR-T渗入肿瘤清除TAM?
为了回答这个问题,研究小组构建了HKP1非小细胞小鼠模型,然后给F4输血。将CAR-T细胞注入老鼠体内。通过免疫荧光和流式细胞仪,他们发现了大量的F4。CAR-T细胞浸润到肿瘤中,同时伴有TAM数量的显著减少。
这些数据表明F4。CAR-T细胞可以有效地渗入肿瘤并杀死TAM。
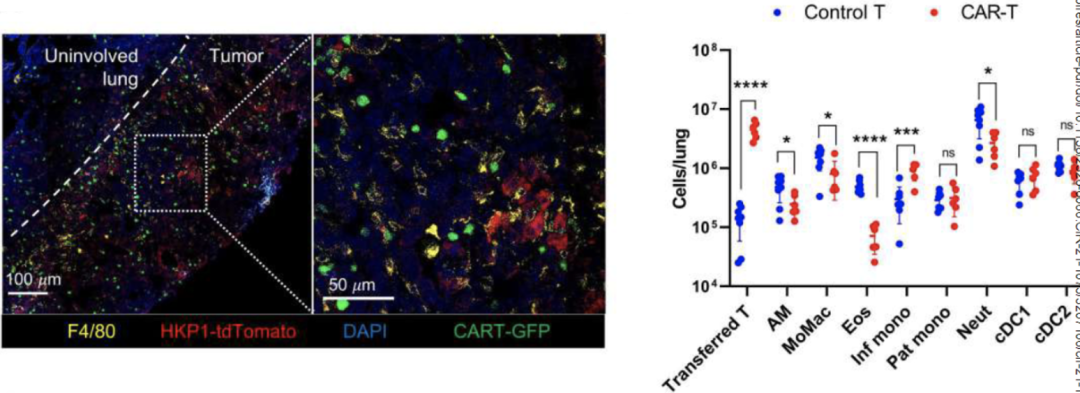
F4。CAR-T可以渗入肿瘤杀死TAM。
F4。CAR-T可以减少TAM的数量,那么这样可以减缓肿瘤的进展吗?
研究小组观察了移植F4的小鼠的肿瘤负荷和荷瘤存活时间。CAR-T细胞,并发现移植有F4的小鼠肿瘤体积增大。CAR-T细胞比移植对照T细胞的小鼠小,且荷瘤存活时间明显延长。
这些数据表明,F4的转移。CAR-T细胞能显著延缓肿瘤进展,延长小鼠荷瘤存活时间。
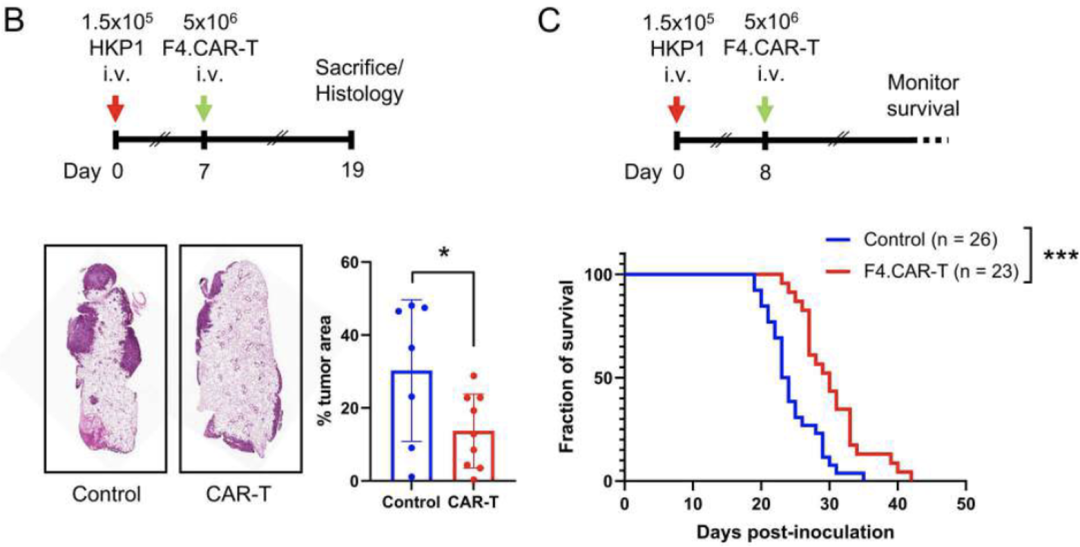
F4输血。CAR-T显著抑制肿瘤生长并延长生存期。
当使用免疫荧光检查小鼠的肿瘤组织时,研究小组注意到,在治疗组小鼠的肿瘤细胞中,荧光标记tdTomato的表达水平显著下降。考虑到以前的研究表明,荧光蛋白GFP也能被荷瘤小鼠的T细胞检测到,作为肿瘤特异性抗原,并且GFP的表达水平与MHC的表达水平呈负相关[5]。他们怀疑tdTomato也可能代表一种肿瘤特异性抗原,其表达量的减少可能与MHC表达水平的增加有关,从而使肿瘤更容易被免疫系统杀死。
为了验证这一猜想,研究小组分析了tdTomato在肿瘤细胞中的荧光强度和MHC表达水平,发现与没有F4的小鼠相比。F4小鼠肿瘤细胞中CAR-T细胞、tdTomato的荧光强度。CAR-T细胞明显减少,但MHC 和MHC 的表达明显增加。
肿瘤细胞中tdTomato的减少和MHC表达的增加与肿瘤负荷的降低有关,提示F4。CAR-T疗法可能促进内源性T细胞对tdTomato肿瘤细胞的免疫反应。
为了检测内源性T细胞的应答,研究团队使用了四聚体技术检测识别荧光素酶优势表位(HKP1细胞表达这个表位)的CD8+T细胞,发现与未转输F4.CAR-T细胞的小鼠相比,接受F4.CAR-T细胞治疗的小鼠肿瘤中浸润了更多的荧光素酶特异性CD8+T细胞。
以上数据表明,使用F4.CAR-T细胞进行治疗不仅能够有效清除肿瘤内TAM,还能够增加内源性肿瘤特异性T细胞的数量,对肿瘤进行杀伤与免疫编辑(表现为tdTomato表达降低)。
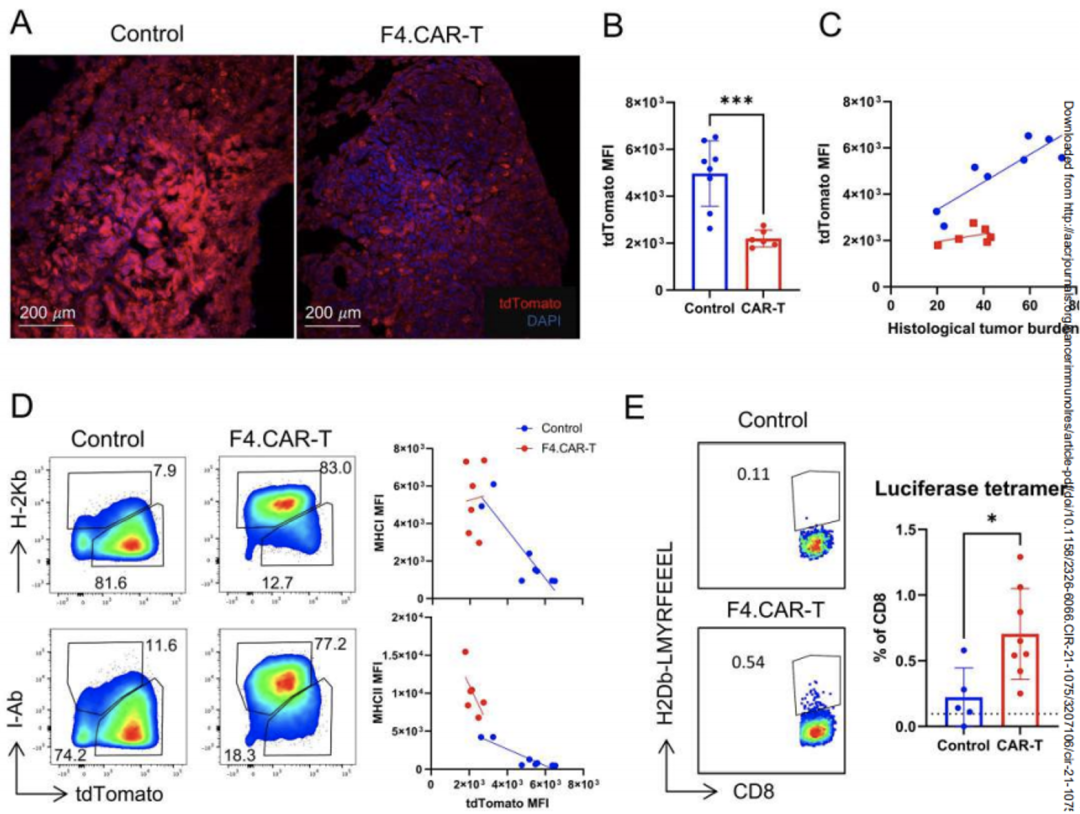
F4.CAR-T细胞治疗激发内源性T细胞免疫应答
已有研究表明,HKP1肿瘤对PD-1抑制剂治疗敏感,那么F4.CAR-T细胞治疗的效果与PD-1抑制剂相比如何呢?两者是否会有协同作用?
为了探究上述问题,研究团队为荷瘤小鼠进行了PD-1抑制剂单药治疗、F4.CAR-T细胞单药治疗以及二者联合治疗。结果显示,PD-1抑制剂和F4.CAR-T细胞均能够抑制肿瘤生长,但是两者并无协同作用。这也表明,F4.CAR-T细胞和PD-1抑制剂都是通过增强内源性T细胞应答来增强抗肿瘤能力的。
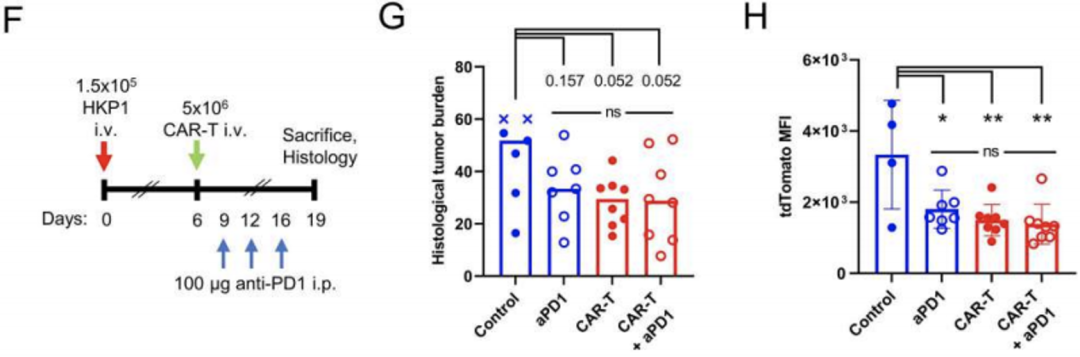
F4.CAR-T细胞与PD-1抑制剂无协同作用
CD8+T细胞对靶细胞的杀伤依赖于靶细胞表面抗原肽:MHCI复合物的存在,已有的研究结果表明在转输F4.CAR-T细胞后肿瘤细胞上调表达MHCI,这可能是F4.CAR-T细胞促进内源性T细胞应答的重要机制,那么F4.CAR-T是如何促进肿瘤上调表达MHCⅠ的呢?
我们都知道,活化的CD8+T细胞可以产生大量的IFN- ,而IFN- 能够诱导MHCI的表达,因此研究人团队猜想或许是肿瘤中活化的F4.CAR-T细胞在杀伤TAM时释放的IFN- 诱导肿瘤细胞上调表达MHCI。
为了证明这个猜想,研究团队构建了IFN- 缺陷的F4.CAR-T细胞,并将其转输至荷瘤小鼠体内。结果显示,与转输WT F4.CAR-T细胞相比,转输Ifng-/-F4.CAR-T细胞后肿瘤细胞上MHCI的表达显著降低。这表明上述猜想是正确的。
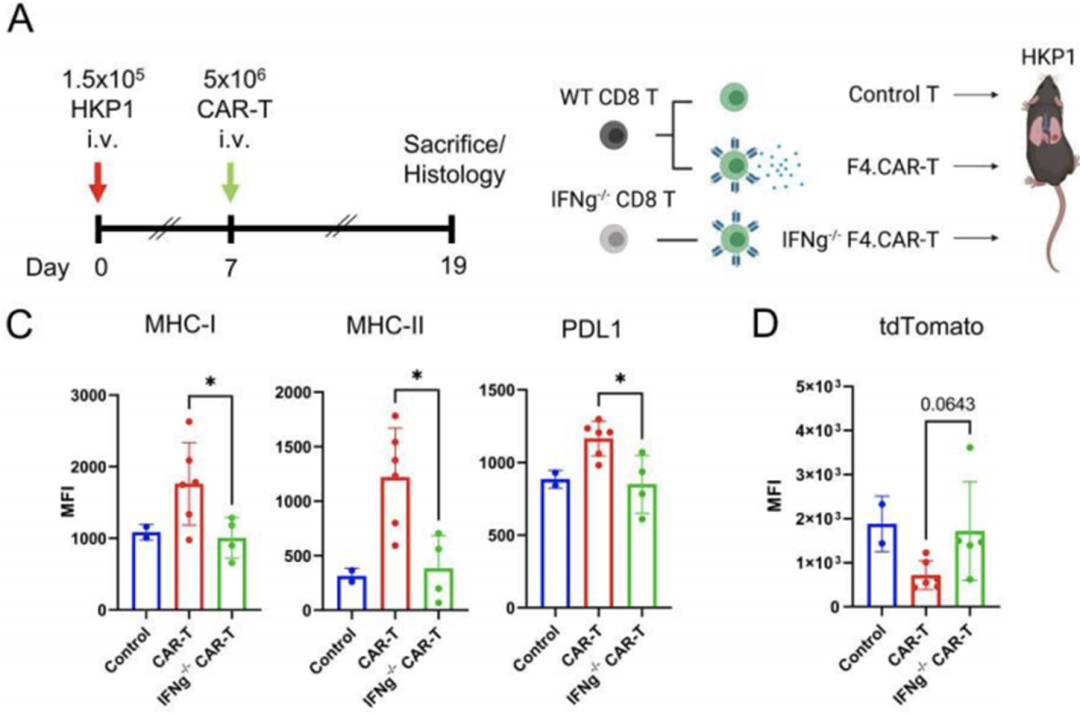
F4.CAR-T细胞产生的IFN- 诱导肿瘤细胞上调表达MHCI
最后,研究团队在两种富含巨噬细胞的肿瘤模型(ID8以及)中测试了F4.CAR-T细胞的治疗效果。结果显示,F4.CAR-T细胞对这两种恶性肿瘤均有治疗效果,显著地抑制了肿瘤的生长。
这些数据表明,F4.CAR-T细胞疗法在多种肿瘤中均有良好的治疗潜力。
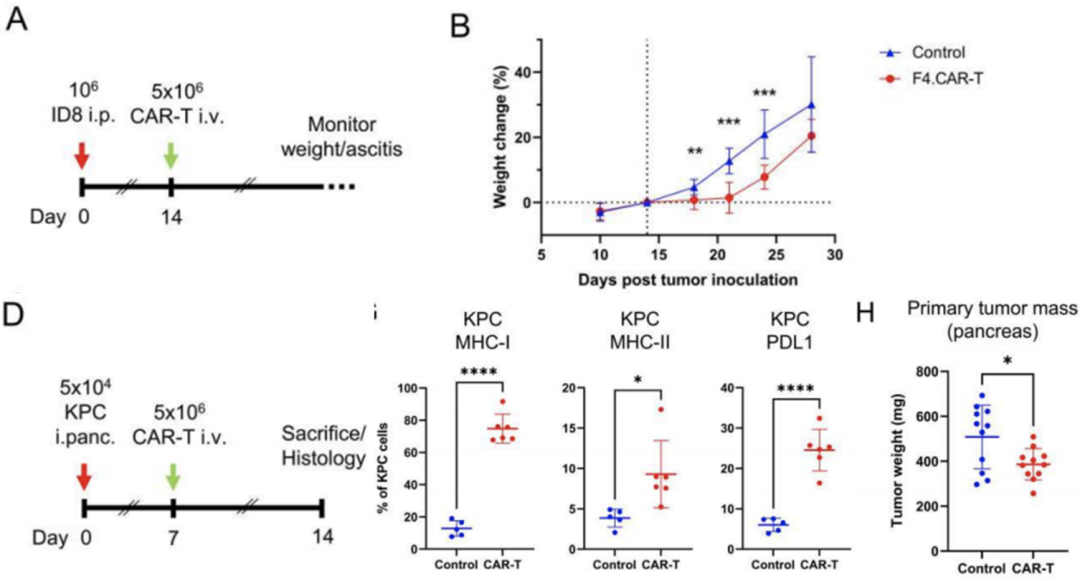
F4.CAR-T对多种恶性肿瘤均有治疗效果
总而言之,这项研究成果从概念上验证了,靶向巨噬细胞表面F4/80的CAR-T细胞可以发挥良好的抗肿瘤作用。其机制包括清除具有免疫抑制作用的TAM;上调肿瘤细胞表面的MHC,促进内源性T细胞免疫应答。这个研究也为后续开发清除TAM的CAR-T疗法提供了支撑。
参考文献:
1. Mantovani A, Marchesi F, Malesci A, Laghi L, Allavena P. Tumour-associated macrophages as treatment targets in oncology. Nature Reviews Clinical Oncology. Nature Publishing Group; 2017;14:399 416.
2. Noy R, Pollard JW. Tumor-Associated Macrophages: From Mechanisms to Therapy. Immunity. Elsevier Inc.; 2014;41:49 61
3. Cannarile MA, Weisser M, Jacob W, Jegg A-MM, Ries CH, R ttinger D. Colony-stimulating factor 1 receptor (CSF1R) inhibitors in cancer therapy. Journal for ImmunoTherapy of Cancer. Journal for ImmunoTherapy of Cancer; 2017;5:1 13
4. Sanchez-Paulete AR, Mateus-Tique J, Mollaoglu G, et al. Targeting macrophages with CAR T cells delays solid tumor progression and enhances anti-tumor immunity. Cancer Immunol Res. 2022;CIR-21-1075. doi:10.1158/2326-6066.CIR-21-1075
5. Wroblewska A, Dhainaut M, Ben-Zvi B, Rose SA, Park ES, Amir E-AAD, et al Protein Barcodes Enable High-Dimensional Single-Cell CRISPR Screens. Cell. Elsevier Inc.; 2018;175:1141-1155.e16.
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- Nature:DNA甲基化“随机时钟”——EVOFLUX破译肿瘤演化史,重塑临床预后新维度 (2025-09-13)
- GLP-1新战场:礼来、信达、恒瑞再交锋 (2025-09-13)
- Nature Methods:解锁细胞宇宙的“星图”——scvi-hub如何将海量单细胞数据“浓缩”到你的笔记本电脑里? (2025-09-13)
- 为什么精子会“跑不动”?大阪大学揪出两大关键蛋白:CFAP91搭起“运动支架”,EFCAB5调控“冲刺力”,男性生育有了新靶点 (2025-09-12)
- 突破!肺癌细胞转移大脑后竟会与神经元“串通”!Nature 新研究揭致命机制,抗癫痫药或成新希望 (2025-09-12)
- J Neurochem:肠道与大脑的“对话”——科学家揭秘机体慢性疼痛的神经通路 (2025-09-11)
- 母亲高血糖,影响后代生育能力,黄荷凤院士团队等揭示背后的表观遗传机制 (2025-09-11)
- STTT:韩国科学家发现减轻大脑氧化应激损伤、减少神经退行性病变的新方法! (2025-09-11)
- 《癌症研究》:橄榄油吃太多,乳腺癌易挪窝!美国科学家发现,富含橄榄油的高脂饮食,会促进三阴性乳腺癌肺转移 (2025-09-11)
- 减重竟还能减痛?!EJN:饮食质量提升 22%,慢性疼痛率直降一半,体脂变化竟不是关键 (2025-09-11)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















