STTT:重庆医科大学黄爱龙团队发现乙肝病毒促肝癌的新伎俩! |
 |
来源:奇点糕 2023-02-28 14:53
OGT抑制剂不仅在体内降低YTHDF2的O-GlcNAc糖基化水平、下调MCM2/5表达,更能有效减缓小鼠肝脏肿瘤发生的速度、缩小肿瘤体积,并减轻肝功能损伤水平。据,全球超过一半的肝细胞癌(HCC)诱因是乙型肝炎病毒(HBV)慢性感染[1,2]。
然而,HBV感染引起HCC的分子机制,目前仍然没有完全弄清楚。这一现状严重阻碍了HBV相关HCC的预防和治疗。如果能深入了解背后机制,找到新的治疗靶点,对于改善HCC患者的预后无疑具有重要意义。
近日,由重庆医科大学病毒性肝炎研究所黄爱龙领衔的研究团队,在著名期刊Signal Transduction and Targeted Therapy发表研究论文[3],阐述了HBV感染引起HCC发生与进展的新机制。
具体来说,HBV感染能升高YTHDF2的氧连氮-乙酰葡萄糖胺(O-GlcNAc)糖基化修饰水平,让YTHDF2变得更稳定,这进一步又让参与细胞周期的MCM2和MCM5的mRNA变得更稳定,最终实现维持细胞周期和促进的进展。
本研究揭示了YTHDF2调节HCC发生与进展的全新机制,并为开发HBV感染相关的肝癌治疗靶点提供了理论基础。

论文截图
我们都知道,致癌病毒诱发肿瘤最常见的机制,便是将自身遗传物质整合至宿主基因组。但狡猾的HBV还是一种 代谢病毒 ,能扰乱肝细胞的多种代谢通路,使肝细胞一路滑进肿瘤的深渊。
与己糖胺代谢通路相关的氧连氮-乙酰葡萄糖胺(O-GlcNAc)糖基化修饰,与其他多种病毒的致癌效应有关[4,5],在HBV感染后也有所升高[6]。
O-GlcNAc糖基化修饰是一种由O-GlcNAc转移酶(OGT)催化的蛋白翻译后修饰,而O-GlcNAc水解酶(OGA)负责移除GlcNAc。在多种被O-GlcNAc糖基化的宿主蛋白中,YTHDF2引起了研究人员的注意。大量的研究表明,YTHDF2可以识别mRNA上的N6-腺苷酸甲基化(m6A)修饰、有利于mRNA的稳定、促进其翻译[7-10]。
黄爱龙团队注意到,在HBV感染相关的HCC组织中,YTHDF2的O-GlcNAc糖基化水平随着总O-GlcNAc糖基化水平一同升高,且HCC组织的YTHDF2蛋白表达水平也高于非肿瘤组织。究其背后原因,原来HBV感染导致的O-GlcNAc糖基化修饰会增强YTHDF2的稳定性。
接下来就该看看YTHDF2在HCC中如何 助纣为虐 了。
YTHDF2所含的YTH结构域能特异性识别RNA的m6A修饰位点,但这一亲和力并不会随着YTHDF2的O-GlcNAc糖基化水平改变而改变。虽然O-GlcNAc糖基化并不会直接影响YTHDF2的功能,但蛋白的稳定性增加,就可以更长久地发挥作用。
在感染HBV的细胞中,敲降YTHDF2可抑制细胞增殖、侵袭和迁移,还能抑制成瘤,重新表达野生型YTHDF2可恢复细胞的上述活动,但重新表达S263A突变体则不改变敲降效应。也就是说,HBV感染引起HCC,要抓的不光是YTHDF2,还得是O-GlcNAc糖基化的YTHDF2。
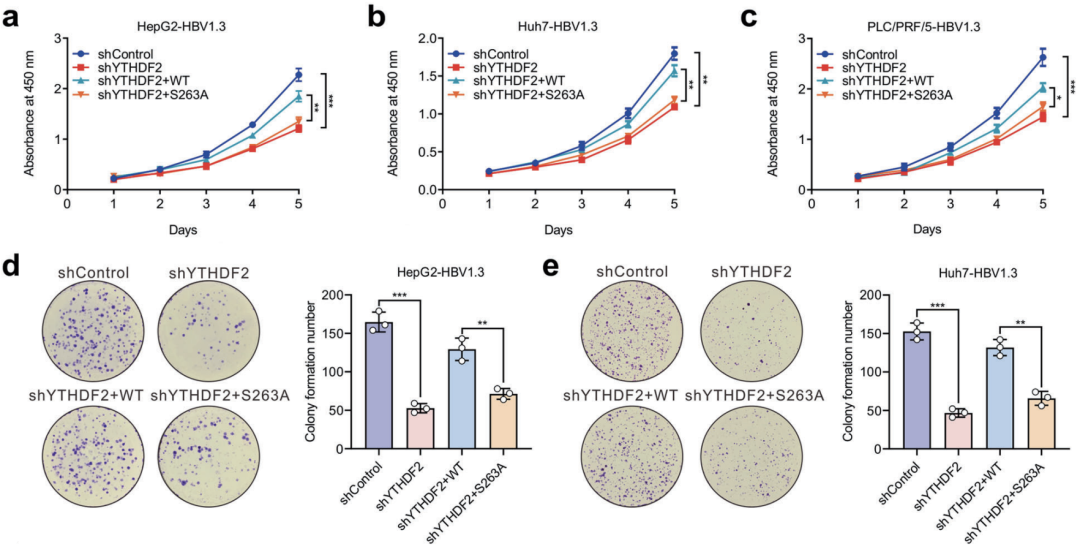
YTHDF2敲降与重新表达,对细胞增殖的影响
看到这里你可能也想问,m6A修饰的mRNA有那么多,到底哪些是和HCC有关的呢?
研究人员针对HBV感染的HepG2细胞,用RNA-seq、m6A-seq和RNA共沉淀(RIP-seq)探究了YTHDF2的靶基因。结合三种测序的差异基因交集和RT-qPCR验证,MCM2和MCM5浮出了水面。

RNA-seq、m6A-seq和RIP-seq差异基因韦恩图
MCM2/5对于DNA复制的启动至关重要,有助于维持正常的细胞周期[11,12]。
进一步的实验表明,MCM2/5的mRNA和蛋白水平都与YTHDF2的O-GlcNAc糖基化水平正相关,且YTHDF2的O-GlcNAc糖基化有利于MCM2/5mRNA增强3 UTR活性、延长半衰期。
而失去m6A识别能力的YTHDF2 W432A突变体与MCM2/5的相互作用比野生型更弱,也无法增加MCM2/5的表达。也就是说,在HBV感染相关HCC中,O-GlcNAc糖基化的YTHDF2通过识别m6A,稳定MCM2/5转录本,从而促进肿瘤发生与进展。
不过,研究人员并没有就此停下探寻的脚步,他们还利用多种HCC动物模型进一步验证了前述细胞实验的结论,并且检验了O-GlcNAc转移酶OGT作为HBV相关HCC治疗靶点的潜能。
他们发现,OGT抑制剂不仅在体内降低YTHDF2的O-GlcNAc糖基化水平、下调MCM2/5表达,更能有效减缓小鼠肝脏肿瘤发生的速度、缩小肿瘤体积,并减轻肝功能损伤水平。在HCC患者中,也是YTHDF2和MCM2/MCM5水平较高的患者总生存期更短。
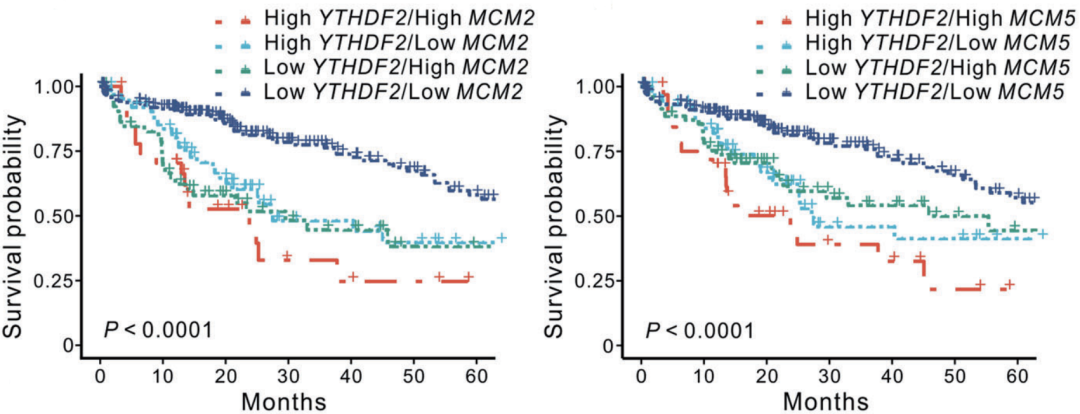
YTHDF2和MCM2/MCM5表达水平不同的HCC患者总生存期
基于本研究,靶向YTHDF2及其O-GlcNAc糖基化来干预HBV相关HCC,或许可以成为一个新的治疗思路。
参考文献:
[1] Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.CA Cancer J Clin. 2021;71(3):209-249. doi:10.3322/caac.21660
[2] Jia L, Gao Y, He Y, Hooper JD, Yang P. HBV induced hepatocellular carcinoma and related potential immunotherapy.Pharmacol Res. 2020;159:104992. doi:10.1016/j.phrs.2020.104992
[3] Yang Y, Yan Y, Yin J, et al. O-GlcNAcylation of YTHDF2 promotes HBV-related hepatocellular carcinoma progression in an N6-methyladenosine-dependent manner.Signal Transduct Target Ther. 2023;8(1):63. Published 2023 Feb 10. doi:10.1038/s41392-023-01316-8
[4] Groussaud D, Khair M, Tollenaere AI, et al. Hijacking of the O-GlcNAcZYME complex by the HTLV-1 Tax oncoprotein facilitates viral transcription.PLoS Pathog. 2017;13(7):e1006518. Published 2017 Jul 24. doi:10.1371/journal.ppat.1006518
[5] Zeng Q, Zhao RX, Chen J, et al. O-linked GlcNAcylation elevated by HPV E6 mediates viral oncogenesis.Proc Natl Acad Sci U S A. 2016;113(33):9333-9338. doi:10.1073/pnas.1606801113
[6] Hu J, Gao Q, Yang Y, et al. Hexosamine biosynthetic pathway promotes the antiviral activity of SAMHD1 by enhancing O-GlcNAc transferase-mediated protein O-GlcNAcylation.Theranostics. 2021;11(2):805-823. Published 2021 Jan 1. doi:10.7150/thno.50230
[7] Zhu T, Roundtree IA, Wang P, et al. Crystal structure of the YTH domain of YTHDF2 reveals mechanism for recognition of N6-methyladenosine.Cell Res. 2014;24(12):1493-1496. doi:10.1038/cr.2014.152
[8] Wang X, Lu Z, Gomez A, et al. N6-methyladenosine-dependent regulation of messenger RNA stability.Nature. 2014;505(7481):117-120. doi:10.1038/nature12730
[9] Du H, Zhao Y, He J, et al. YTHDF2 destabilizes m(6)A-containing RNA through direct recruitment of the CCR4-NOT deadenylase complex. Nat Commun. 2016;7:12626. Published 2016 Aug 25. doi:10.1038/ncomms12626
[10] Zhang C, Huang S, Zhuang H, et al. YTHDF2 promotes the liver cancer stem cell phenotype and cancer metastasis by regulating OCT4 expression via m6A RNA methylation.Oncogene. 2020;39(23):4507-4518. doi:10.1038/s41388-020-1303-7
[11] Petropoulos M, Champeris Tsaniras S, Taraviras S, Lygerou Z. Replication Licensing Aberrations, Replication Stress, and Genomic Instability.Trends Biochem Sci. 2019;44(9):752-764. doi:10.1016/j.tibs.2019.03.011
[12] Yu S, Wang G, Shi Y, Xu H, Zheng Y, Chen Y. MCMs in Cancer: Prognostic Potential and Mechanisms.Anal Cell Pathol (Amst). 2020;2020:3750294. Published 2020 Feb 3. doi:10.1155/2020/3750294
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载-> 医药网新闻
医药网新闻

- 相关报道
-
- 金赛药业携手全球最大的脱敏治疗药企ALK,有望开启中国脱敏治疗新时代 (2025-09-18)
- Nature Methods:当百年病理学遇见AI——iSCALE赋能H&E图像,预测细胞级空间转录组 (2025-09-18)
- 《健康报》专访上海交通大学医学院海南国际医学中心数智医学研究院院长王慧:人工智能推动健康管理深度重构 (2025-09-18)
- Cell Stem Cell:血癌基因DNMT3A的惊人新角色!科学家解锁造血干细胞长寿的奥秘 (2025-09-18)
- 华人学者发表Nature论文,揭示这种基因突变为何会导致阿尔茨海默病 (2025-09-18)
- 为什么感冒鼻塞时,吃东西会没味道?最新Nat. Commun:原来味道不仅需要味觉,还需要嗅觉! (2025-09-18)
- 《自然·免疫学》:打破传统认知!大坪医院/昆明市延安医院团队从头设计多肽,精准抑制细胞焦亡孔道功能,为炎症治疗开辟新途径 (2025-09-17)
- 流感季不用慌!Sci Adv:“抗体鸡尾酒”抗多种毒株还不怕突变,感染5天给药仍能救命 (2025-09-17)
- 新疆放慢构建当代中药家当系统 (2025-09-17)
- 《免疫》:科学家首次发现,最毒乳腺癌在转移前就拿下了抗癌前哨! (2025-09-17)
- 视频新闻
-
- 图片新闻
-
医药网免责声明:
- 本公司对医药网上刊登之所有信息不声明或保证其内容之正确性或可靠性;您于此接受并承认信赖任何信息所生之风险应自行承担。本公司,有权但无此义务,改善或更正所刊登信息任何部分之错误或疏失。
- 凡本网注明"来源:XXX(非医药网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。本网转载其他媒体之稿件,意在为公众提供免费服务。如稿件版权单位或个人不想在本网发布,可与本网联系,本网视情况可立即将其撤除。联系QQ:896150040





















